1 引言
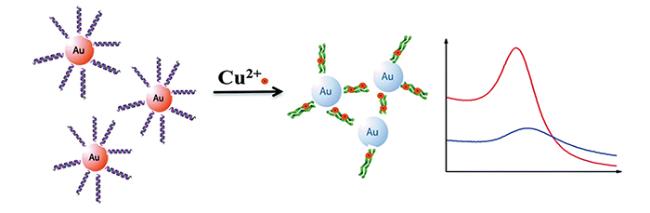
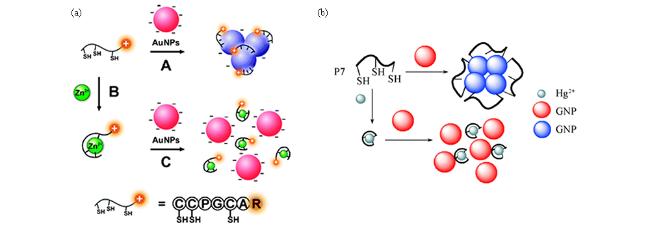
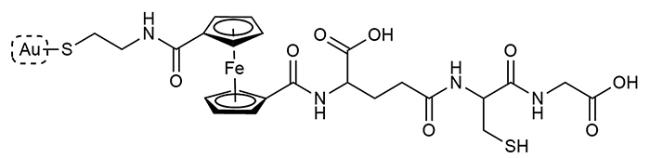
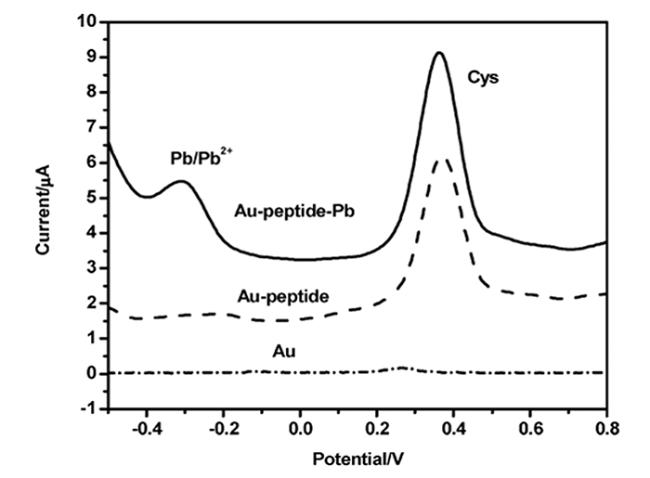
2 多肽基紫外-可见比色传感器
3 多肽基荧光化学传感器
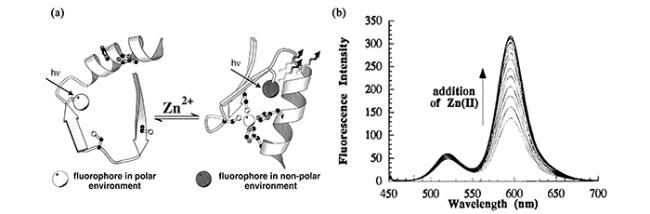
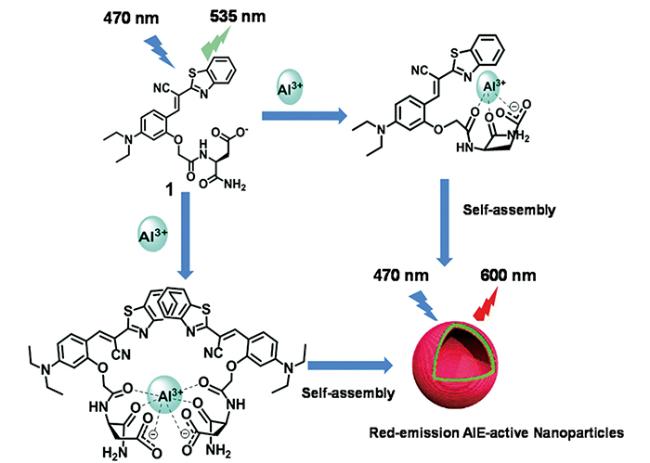
3.1 荧光化学传感器的机理
表1 多肽基荧光化学传感器及其检出限Table 1 Peptide-based fluorescent chemical sensors and their limits of detection |
| Detection agent | Detected metal | LOD(nmol/L) | ref |
|---|---|---|---|
| Dansyl-Cys-Pro-Gly-His-NH2 | Zn2+ | 82 | 36 |
| Dansyl-Gly-Trp-COOH(DGT) Dansyl-Gly-Gly-Trp-COOH(DGTT) | Hg2+、C Hg2+ | - | 37 |
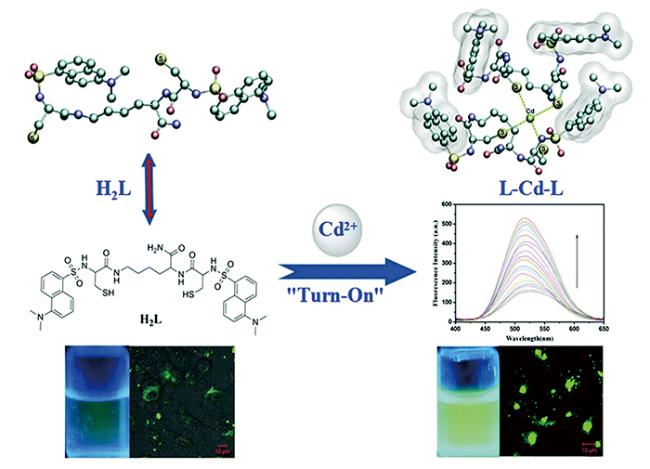
| Dansyl-Cys-Lys-Cys-Dansyl | Cd2+ | 52 | 40 |
| Dansyl-Ser-Pro-Gly-His-NH2 | Cu2+、S2- | 88, 75 | 41 |
| Dansyl-His-Pro-Gly-His-Trp-Gly-NH2 | Zn2+ | 97 | 42 |
| Dansyl-Glu-Pro-Gly-His-NH2 | Zn2+ | 18 | 43 |
| Dansyl-His-Pro-Gly-Glu-NH2 | Zn2+、Cu2+ | 4.9, 15 | 44 |
| Dansyl-Glu-Pro-Gly-Cys-NH2 | Cd2+ | 45 | 45 |
| Dansyl-Ser-Cys-NH2 | Cd2+ | 13.8 | 46 |
| Dansyl-Ser-Pro-Gly-His-Gly-NH2 | Cu2+ | 23.5 | 47 |
| Dansyl-Ser-Lys-Ser-Dansyl | Hg2+ | 7.59 | 48 |
| Dansyl-Gly-Cys-NH2 | Cd2+、Cu2+ | 14.5, 26.3 | 49 |
| Dansyl-Ser-Glu-Glu-NH2 | Al3+ | 230 | 53 |
| Dansyl-Ser-Pro-Gly-His-Trp-Gly-NH2 | Zn2+ | 124 | 56 |
| Dansyl-Cys-Pro-Pro-Cys-Trp-NH2 | C | 11.5 | 58 |
| Dansyl-His-Pro-Gly-Trp-NH2 | Cu2+、Hg2+ | 37, 105 | 59 |
| Dansyl-Gly-His-Gly-Gly-Trp-COOH | Cu2+、Hg2+ | 85, 25 | 60 |
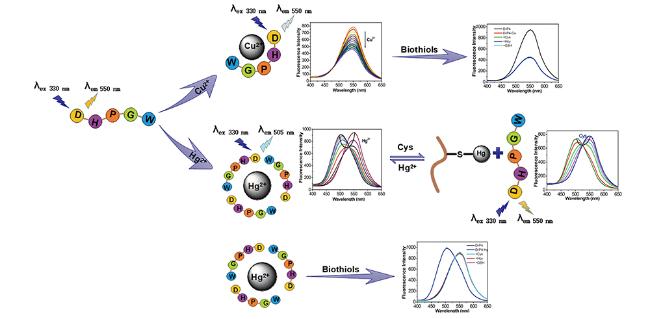
| Dansyl-Glu-Cys-Glu-Trp-NH2 | Hg2+ | 23 | 61 |
| PySO2-His-Gly-Gly-Lys(PySO2)-NH2 | Hg2+ | - | 62 |
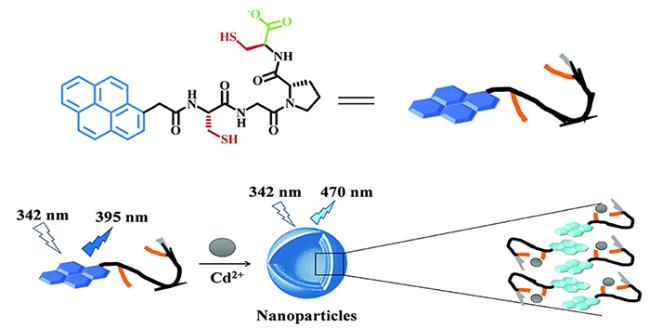
| Py-Cys-Gly-Pro-Cys-COOH | Cd2+ | 23 | 63 |
| Py-Ser-Asp-COOH | Al3+ | 138.1 | 64 |
| Py-Trp-Pro-His-NH2 | Cu+ | - | 66 |
| PySO2-Trp-His-NH2 | Ag+ | - | 67 |
| FAM-Ser-Asp-Lys-Ser-His-Thr-Lys-Dabcyl | Cu2+ | - | 68 |
| FITC-Ahx-Gly-His-Lys-NH2 | Cu2+ | 21.6 | 70 |
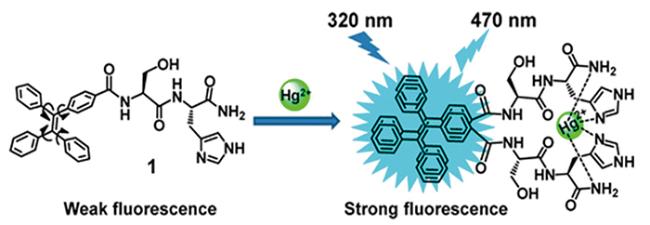
| TPE-Ser-His-CONH2 | Hg2+ | 5.3 | 71 |
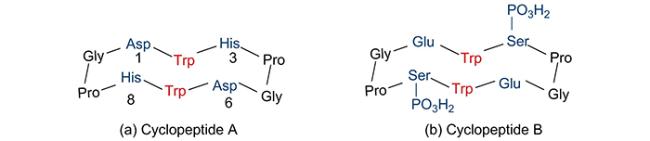
| Cyclopeptide | UO22+ | - | 77 |