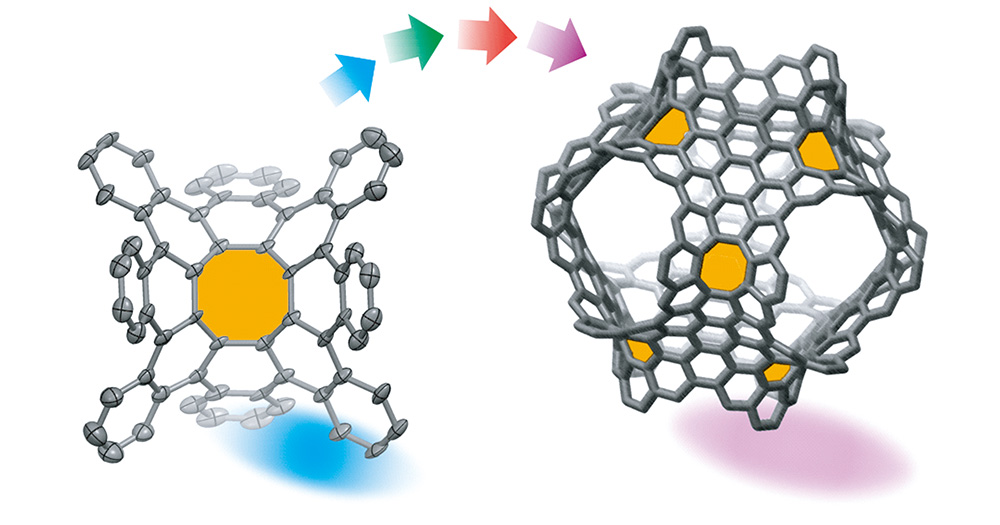
1 简介: 具有负曲率的碳纳米结构
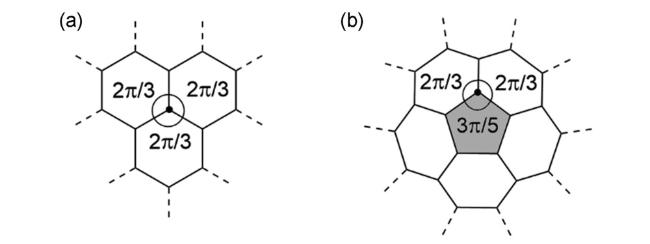
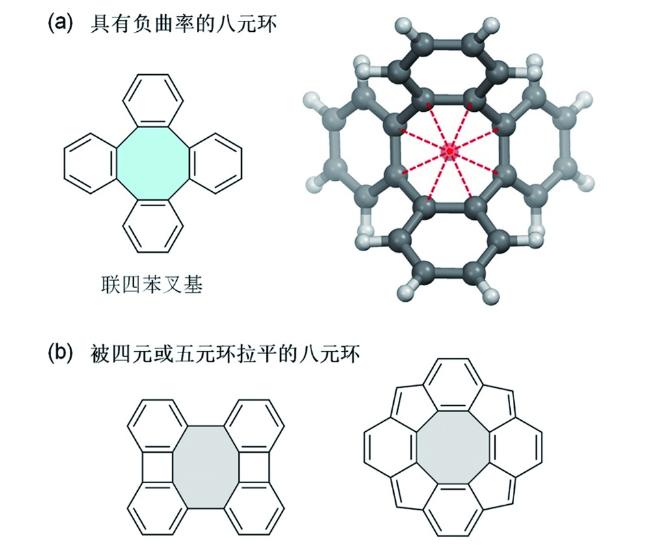
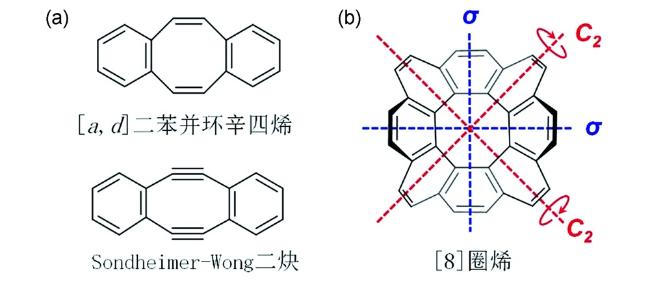
2 含有八元环的结构单元
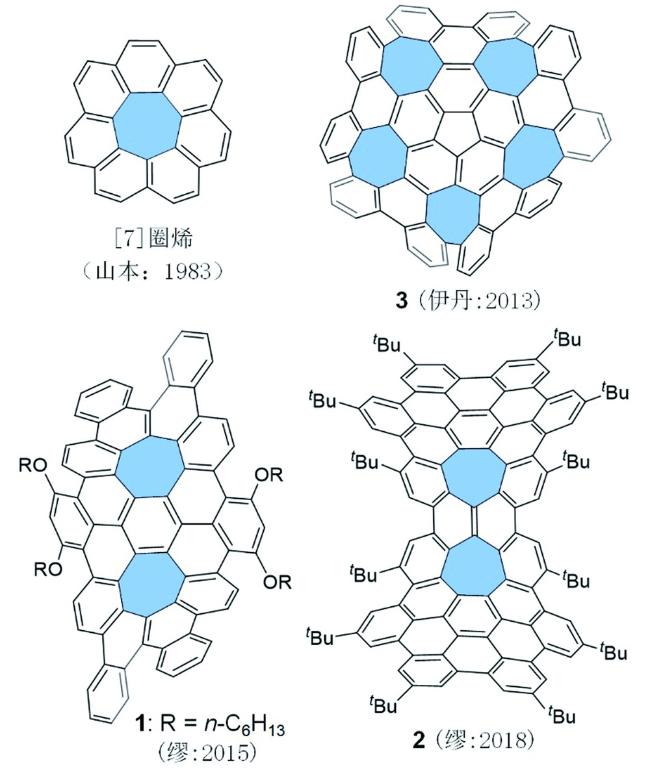
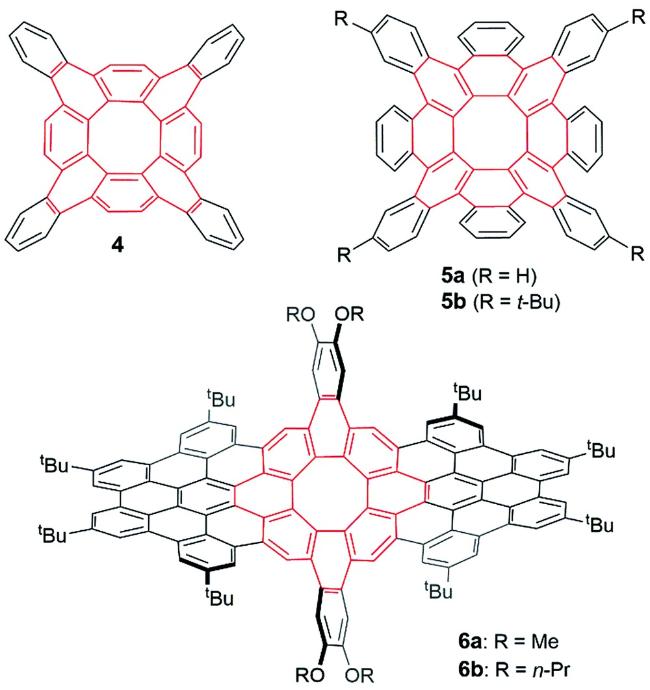
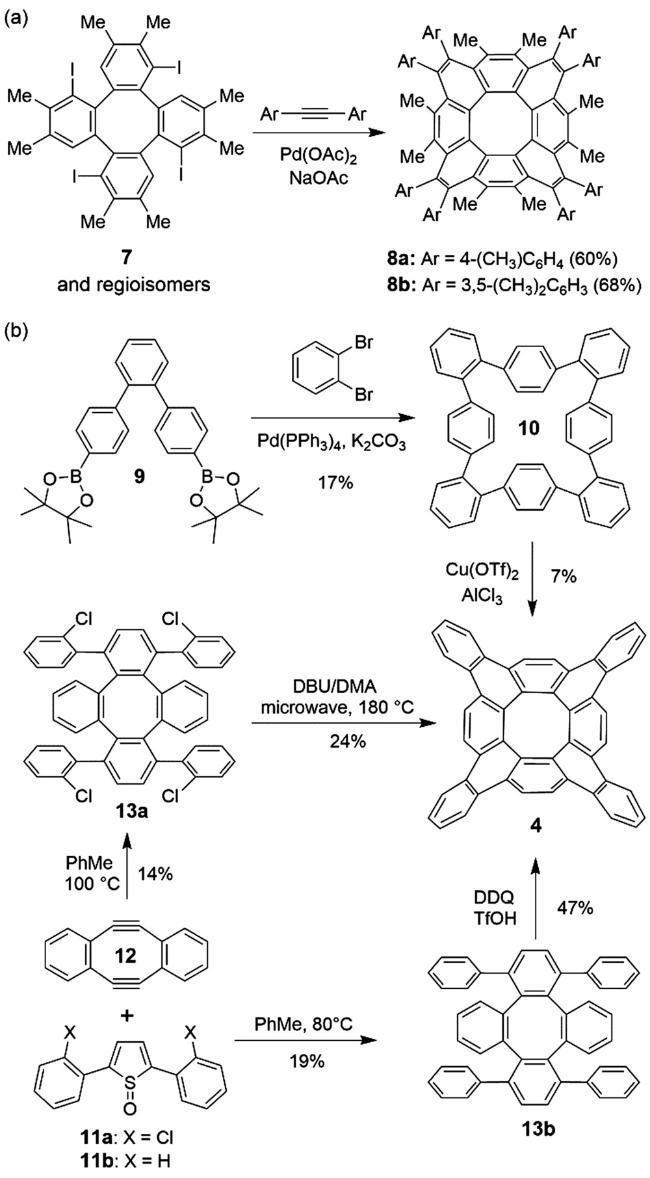
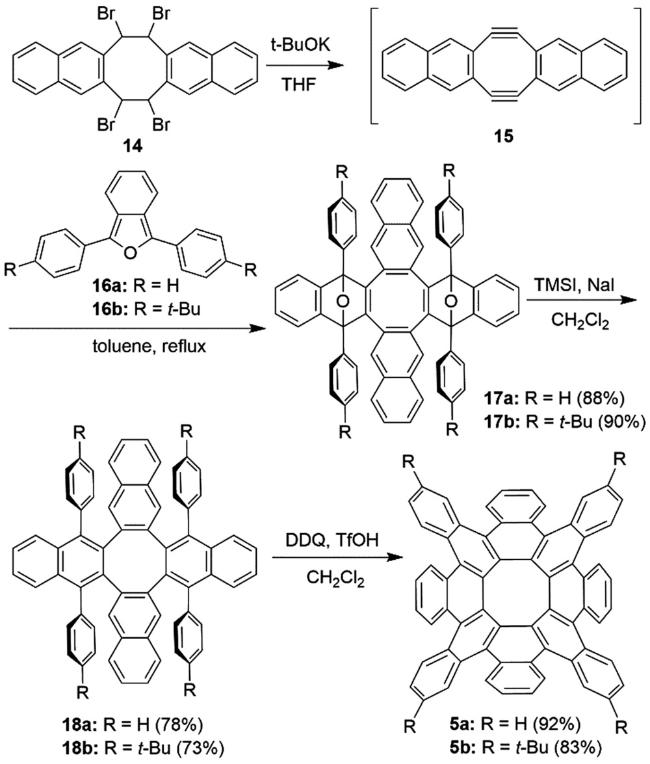
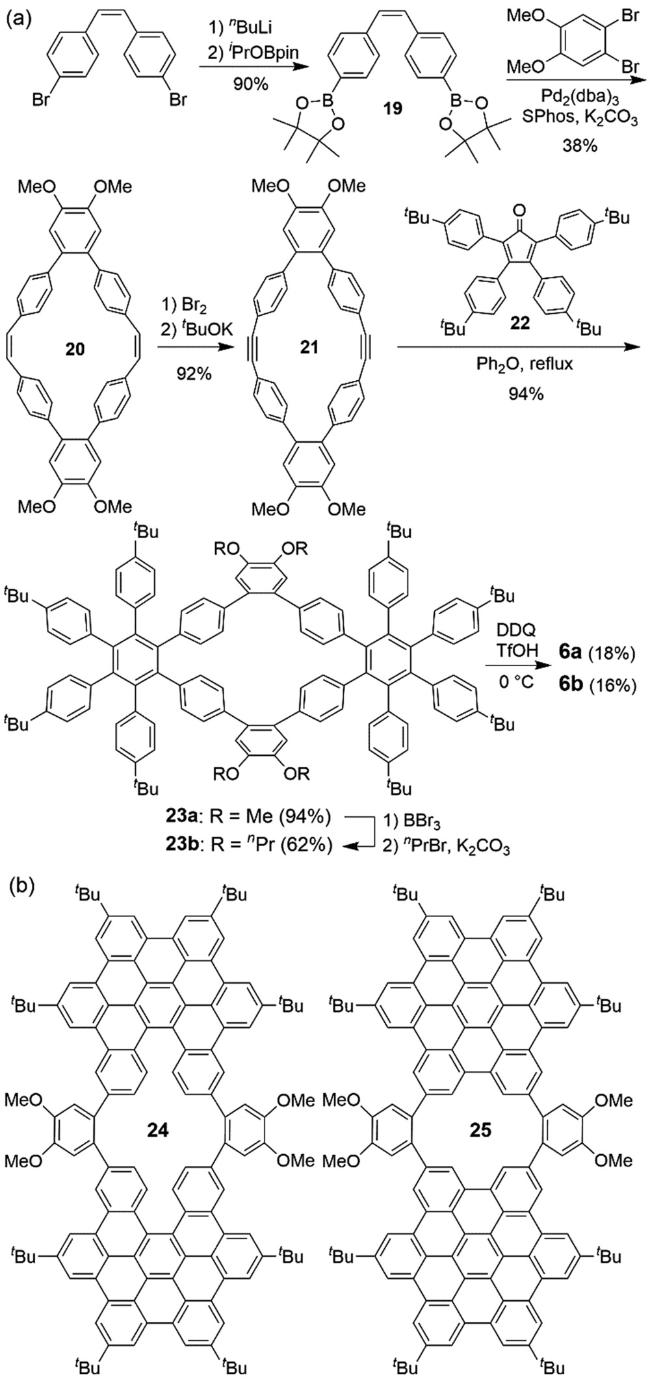
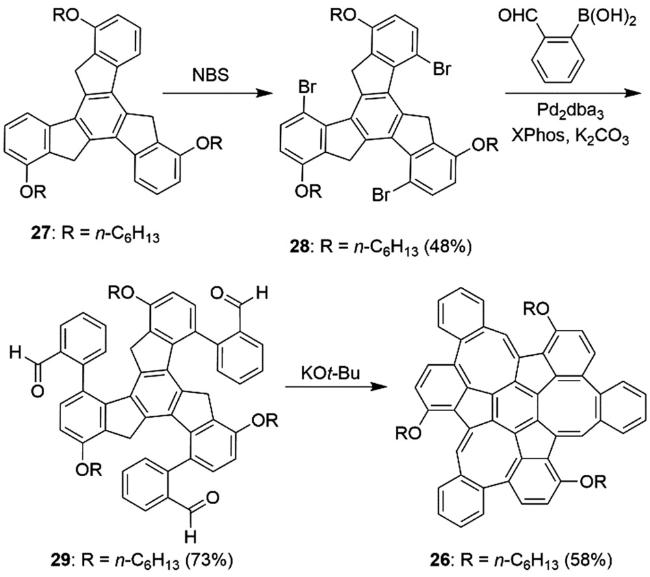
3 具有负曲率的稠环芳烃的设计与合成
4 具有负曲率的稠环芳烃的立体化学及其他特征
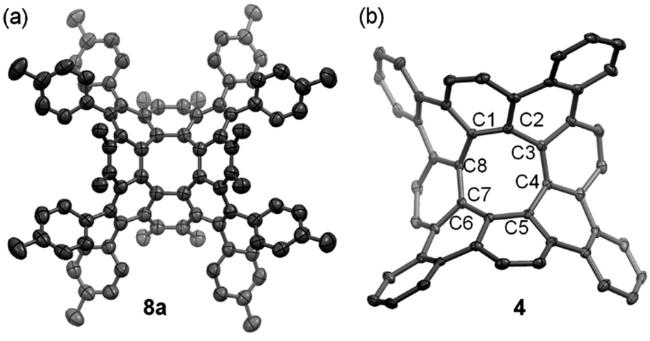
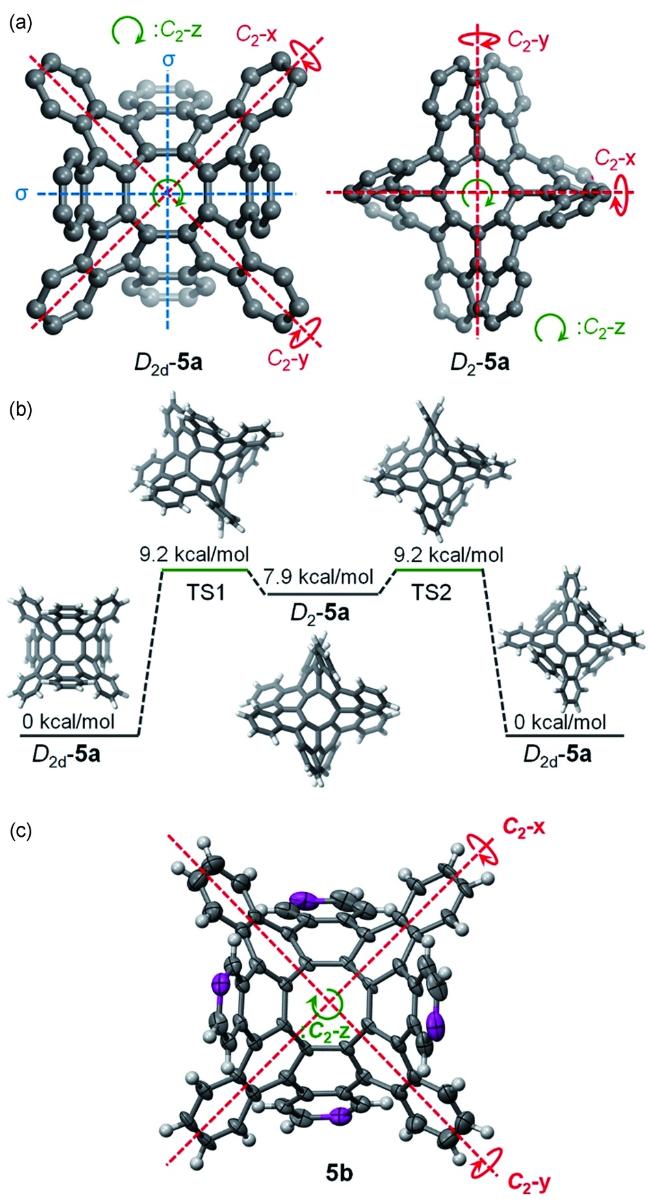
图12 (a) 密度泛函理论计算得出的5a的两种构象;(b) 密度泛函理论计算得出的5a的立体动力学路径(c) 5b的晶体结构(叔丁基未显示,与叔丁基相连的碳原子以洋红色显示)[27]Fig.12 (a) DFT-calculated conformations of 5a;(b) the DFT-calculated stereodynamic pathway of 5a;(c) structure of 5b in single crystals(the tert-butyl groups are removed for clarity, and the carbons that are bonded to tert-butyl groups are shown in magenta)[27]. Copyright 2019, ACS. |
5 结论与展望
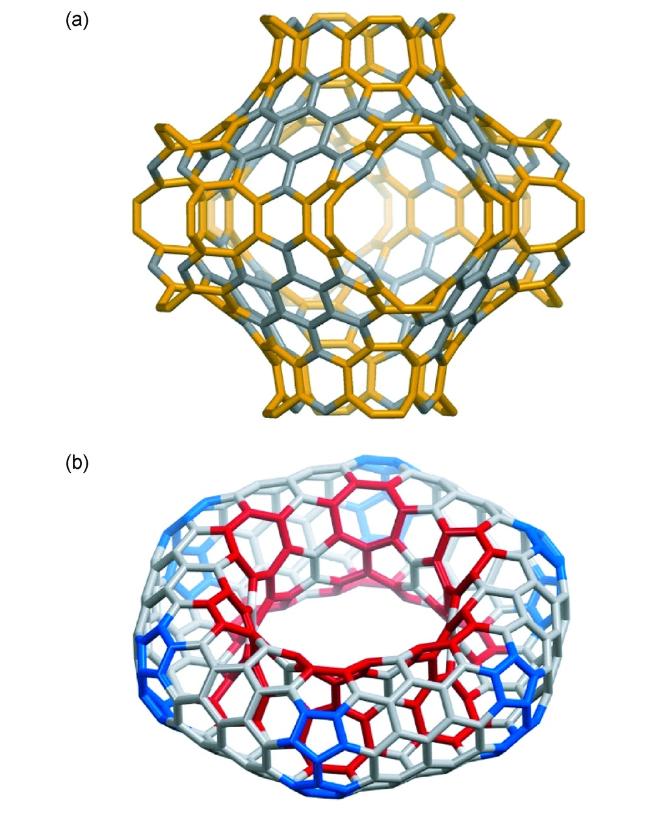
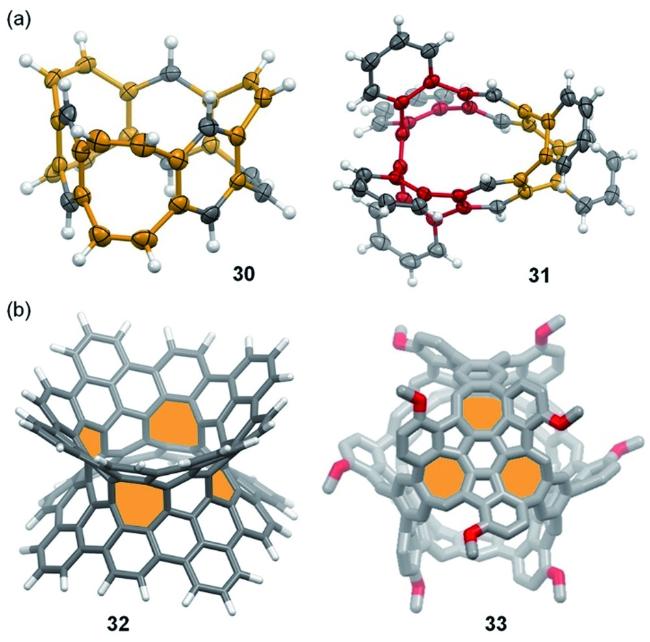
图16 (a) 碳纳米环带30 与碳纳米环31 的晶体结构;(b) 具有负曲率的碳纳米环带32与碳笼33的分子模型(其中的八元环以橙色显示,七元环以红色显示)[29, 32~34]Fig.16 (a) Structures of carbon nanobelt 30 and carbon nanoring 31 in single crystals;(b) molecular models of negatively curved carbon nanobelt 32 and carbon cage33(eight- and seven-membered rings are highlighted with red and orange, respectively)[29, 32~34] |