1 引言
2 生物矿物凝聚态材料的形成
2.1 经典矿化理论
2.2 取向搭接式晶体生长理论
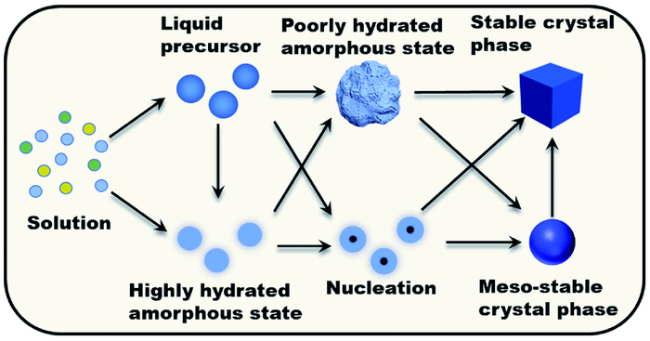
2.3 液态前驱体机制
2.4 介观晶体
3 生物矿物凝聚态材料的转化
3.1 碳酸钙体系
3.2 磷酸钙体系
3.3 二氧化硅体系
3.4 氧化铁体系
4 生物矿物启发的人工凝聚态材料
4.1 生物矿物的力学功能
图3 天然生物矿物凝聚态材料(a)生物矿物力学材料:(逆时针方向)人体骨骼横切面的显微图像[82],贝壳[69],石鳖与石鳖牙齿[65],螳螂虾的锤节[91]、尾甲[96]、鞍部[94];(b)生物矿物功能材料:(逆时针方向)趋磁细菌内部的磁小体[102],海蛇尾[100],深海龙鱼透明牙齿[101],石鳖的背部眼睛[99];(c)其他生物矿物材料:植物中存储的钙盐[103] Fig.3 Natural biomineral condensed matters. (a) Biominerals with mechanical properties:(counterclockwise) microscopic image of the transverse section of human bone[82], copyright 2018, AAAS; nacre[69], copyright 2019, John Wiley and Sons; chiton teeth and chiton[65], copyright 2013, John Wiley and Sons; mantis shrimp dactyl club[91], copyright 2018, John Wiley and Sons; mantis shrimp telson[96],copyright 2019, John Wiley and Sons; mantis shrimp dactyl club saddle[94], copyright 2015, John Wiley and Sons.(b) Biominerals with functional properties:(counterclockwise): magnetosomes in the magnetotactic bacteria[102], copyright 2016, Springer Nature; brittle stars[100], copyright 2001, Springer Nature; transparent teeth of the deep-sea dragonfish[101], copyright 2019, Cell Press; aragonite-based lenses in chiton eye[99], copyright 2015, AAAS.(c) Biominerals with other properties: photomicrograph of calcium oxalate crystals in plants[103], copyright 2011, Elsevier B.V |
4.2 生物矿物的其他功能
4.3 仿生物矿物力学材料
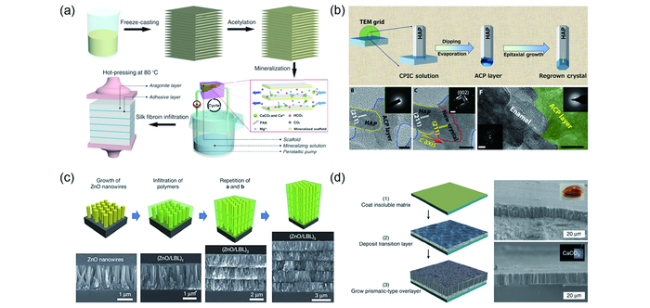
图4 (a)模拟生物矿化过程合成人工珍珠母的过程示意图[109]。(b)通过仿生策略利用磷酸钙离子团簇实现晶体的外延生长及生长前后高分辨透射电镜照片[118]。(c)利用连续层层组装技术人工制备仿牙釉质结构材料的示意图和扫描电镜照片[108]。(d)仿生全合成仿贝壳棱柱层流程图及其与天然棱柱层扫描电镜照片对比[110]Fig.4 (a) Fabrication of synthetic nacre[109], copyright 2016, AAAS.(b) Scheme of a biomimetic mineralization process for epitaxial crystal growth and the HRTEM images before and after the growth [118], copyright 2019, AAAS.(c) Preparation and structure of biomimetic columnar composites[108], copyright 2017, Springer Nature.(d) Total morphosynthesis of biomimetic prismatic-type CaCO3 thin films, and SEM images of synthetic and natural prisms[110], copyright 2017, Springer Nature |