Contents
1 引言
2 指纹残留物的组成
表1 来源于指纹残留物中皮脂腺的目标化合物及其老化动力学[15,16]Table 1 Target compounds from sebaceous identified in fingermark residue and aging kinetics[15,16] |
| Target compounds | Content | Aging kinetics |
|---|---|---|
| Free fatty acids | 37.6% | The concentration of unsaturated fatty acids decreases with time, such as C16 and C18 acids; they are sensitive to light |
| Triglycerides | 25% | Decomposition mechanisms are particularly complex,thermal decomposition yields alkanes, alkenes, alkadienes, aromatics and carboxylic acids |
| Wax esters | 21% | Wax esters are saturated lipids, further research is required to explore their degradation products |
| Squalene | 14.6% | Squalene decreases rapidly over time,it decays more faster in ambient light conditions |
| Cholesterol | 3.8% | The concentration decreases over time, the rate of reduction is affected by the substrate |
2.1 脂肪酸
2.2 甘油酯
2.3 蜡酯
2.4 角鲨烯
2.5 胆固醇
3 影响因素
3.1 遗留者的特征
3.2 沉积条件
3.3 基底的性质
3.4 环境条件
3.5 增强技术
4 指纹遗留时间的测定方法
4.1 色谱法
4.2 光谱法
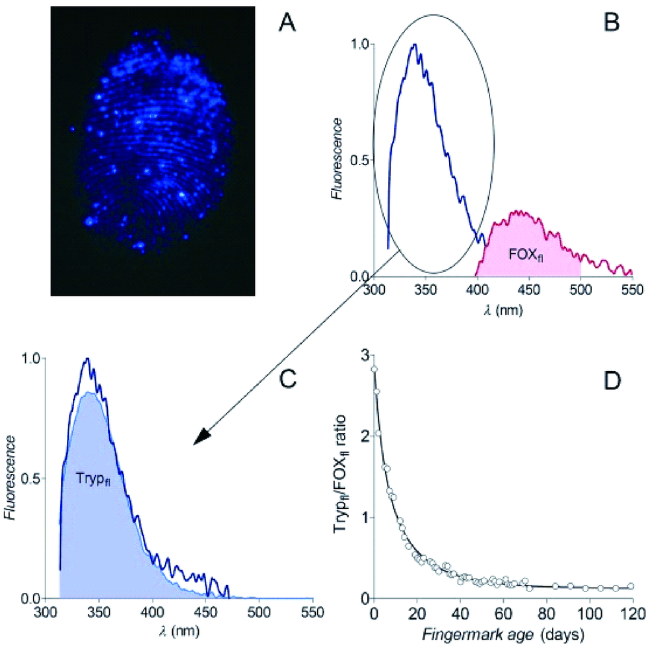
图1 指纹遗留时间评估的步骤图:A)用365 nm光照射的指纹的自发荧光图像。 B)Tryp和FOX荧光发射光谱。蓝线:283 nm激发,红线:365 nm激发。 阴影区域:FOXfl区域的积分面积。C)将B)中测量的Tryp荧光发射光谱(蓝线)进行拟合。D) ⚪:老化指纹Trypfl/FOXfl的比例,黑线:拟合老化曲线[49]Fig. 1 Fingermark age-estimation procedure . A) Autofluorescence image of a fingermark illuminated with 365 nm light. B) Tryp and FOX fluorescence emission spectra. Blue line: excitation at 283 nm, red line: excitation at 365 nm. Shaded area: integrated area for FOXfl determination. C) Fit of reference fluorescence emission spectrum (lavender line) to the measured Tryp fluorescence emission spectrum (blue line) as shown in (B). D)⚪: Trypfl/FOXfl ratio of an aging fingermark, black line: fitted aging curve. Reprinted with permission from ref 49. Copyright 2014 Wiley. |
4.3 质谱法
图5 (a) 9天酯交换反应指纹提取物的GC-MS/MS谱图;(b) 显示了四个不同供体(A,B,C,D)指纹样品的SQ/C15:0比率随光照和时间的变化(短轴:0-没有暴露在光条件下的新鲜指纹) [59]Fig. 5 (a) GC-MS/MS chromatograms of a 9-day-old transesterified fingermark extract;(b) The SQ/C15:0 ratio change dependence on time and light exposure in fingerprint samples of four different donors A, B, C, D(minor axis: 0-fresh fingerprint without exposure to light). Reprinted with permission from ref 59. Copyright 2017 Springer. |
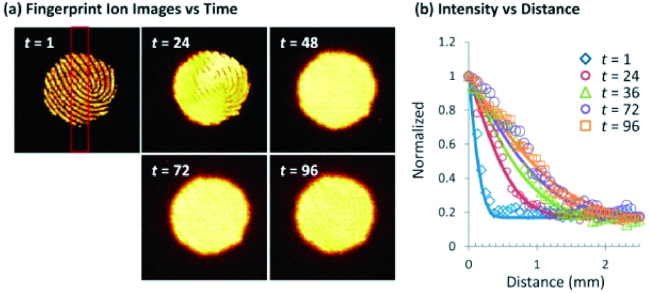
图6 (a)指纹的TOF-SIMS离子图像,显示C16H31O2-(棕榈酸)离子在裸硅晶片的分布,红色矩形部分用于(b)图中的线性扫描;(b)指纹边缘的棕榈酸强度随时间的变化[21]Fig. 6 (a) TOF-SIMS ion images of the fingerprint, showing the distribution of the C16H31O2- ion(palmitic acid) on top of a bare silicon wafer, the red rectangle shows the region of interest(150 pixels wide) that was used to obtain a portion of the linescans shown in part b;(b) the intensity of palmitic acid from the edge of the fingermark as a function of time. Reprinted with permission from ref 21. Copyright 2015 ACS. |
4.4 高分辨率成像的方法
4.5 其他方法
表2 遗留时间测定方法的总结及其优缺点Table 2 Summary of age determination methods together with their advantages and disadvantages |
| Method | Target | Age estimation | Advantage | Disadvantage | ref |
|---|---|---|---|---|---|
| Fluorescence | Tryp / FOX | Three weeks | Non-contact; partially solving variations in composition between donors | The oxidation process is very sensitive to environmental factors such as temperature and light | 49 |
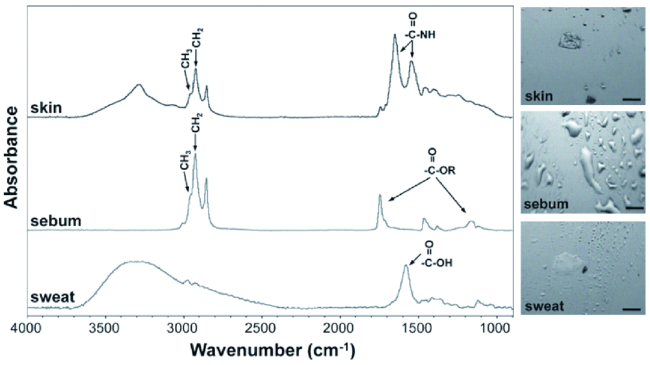
| FTIR | Aliphatic CH3, aliphatic CH2, and carbonyl ester | Four weeks | High spatial resolution; quantitative and non-invasive; examining individual fingerprint components separately | No account for variations between genders | 18 |
| UV-Vis | Eccrine, sebaceous | Three days | Reproducible; providing opportunity to address the strong influence of different sweat compositions on the aging behavior | Fresh prints with a low aging speed as well as aged prints are hard to distinguish | 52 |
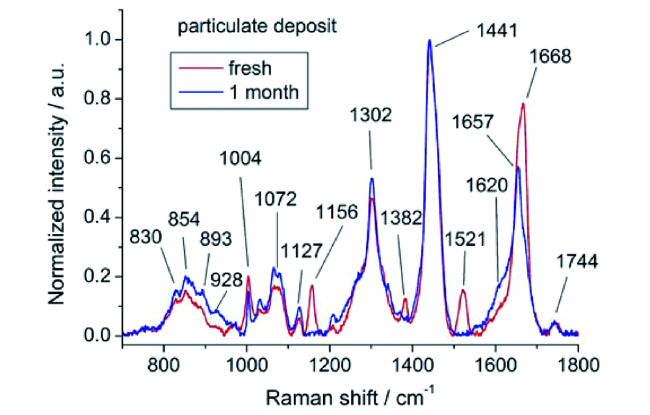
| RS | Carotenoids, squalene, unsaturated fatty acids, proteins | One month | Non-destructive; providinglarger data sets for future statistical analysis | More data will be needed to gain further insight into the different decay mechanisms | 53 |
| GC /MS | Relative peak areas of squalene to cholesterol;PA(Wax esters) / [PA(cholesterol) +PA (squalene)] | One month | Reproducible; reducing partly intra- and inter-variability of fingermark composition | The technique is destructive for the fingermarks | 53 |
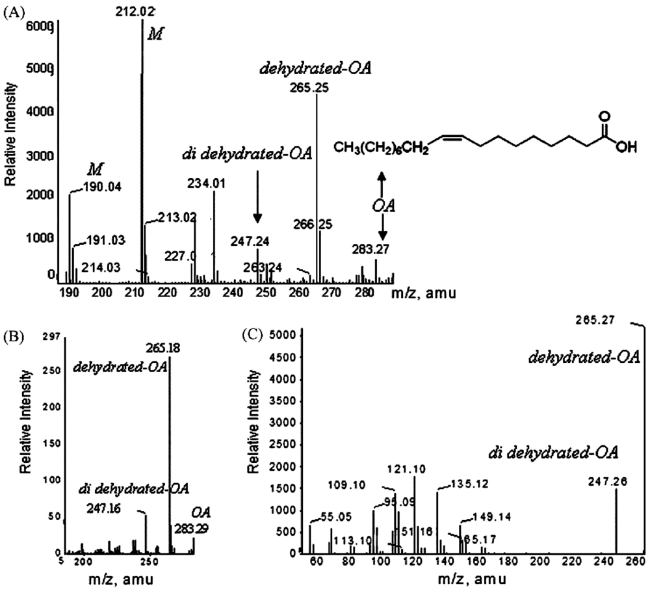
| MALDI-MS | Oleic acid(OA) | Seven days | Non-destructive; high resolution imaging | No account for variations in more environmental factors | 58 |
| GC-MS/MS | SQ/C15:0 | Nine days | Detecting two age different samples on a glass surface from the same donor | Initial component cannot be determined | 59 |
| TOF -SIMS | Palmitic acid | Four days | Detecting and identifing multiple chemical species simultaneously; High resolution and sensitivity | Molecules can degrade or become oxidized upon exposuring to various environmental factors | 21 |
| High- resolution imaging | Minutiae count; color contrast between ridges and furrows;discontinuity index;ridge width | Six months | Non-destructive; quantitative, high resolution and sensitivity | It is not suitable for multiple individuals to study simultaneously | 60~63 |
| Ridge height | One year | Non-destructive, contactless, reobservation, inexpensive cost, without pretreatment, lower error, large area of analysis | Detection limit(insensitive to very thin layers); slow data acquisition times at very high resolutions | 66 |