Contents
1 引言
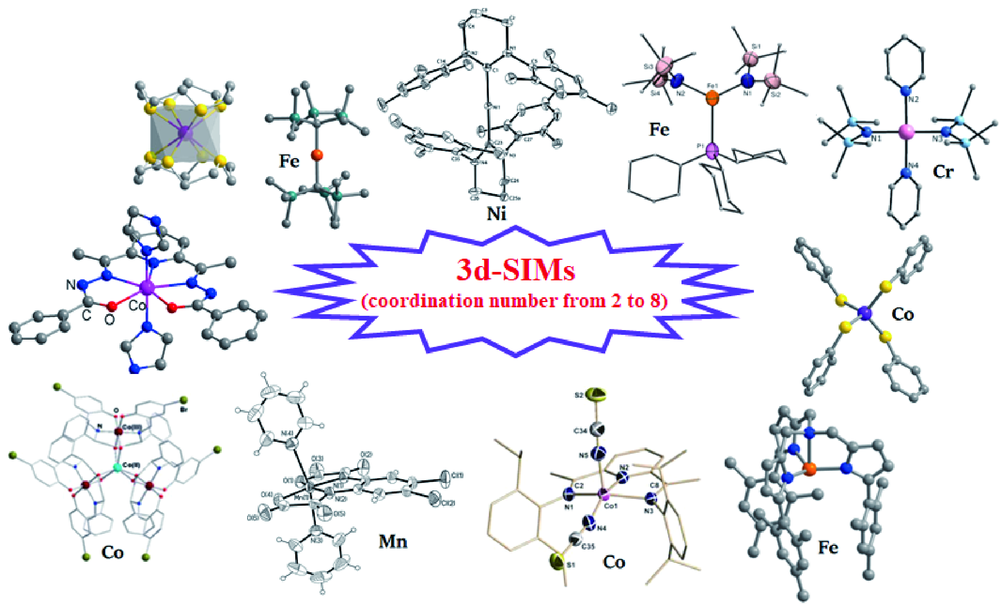
2 二配位的3d-SIMs
3 三配位的3d-SIMs
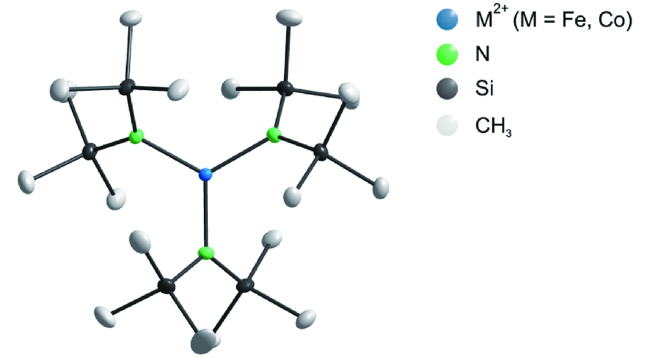
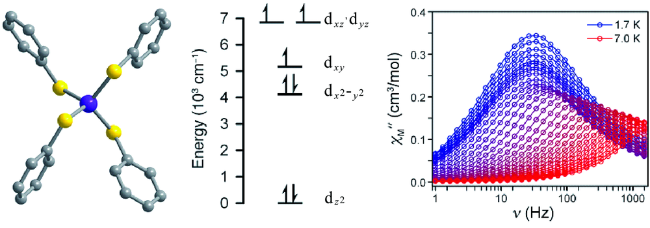
4 四配位的3d-SIMs
5 五配位的3d-SIMs
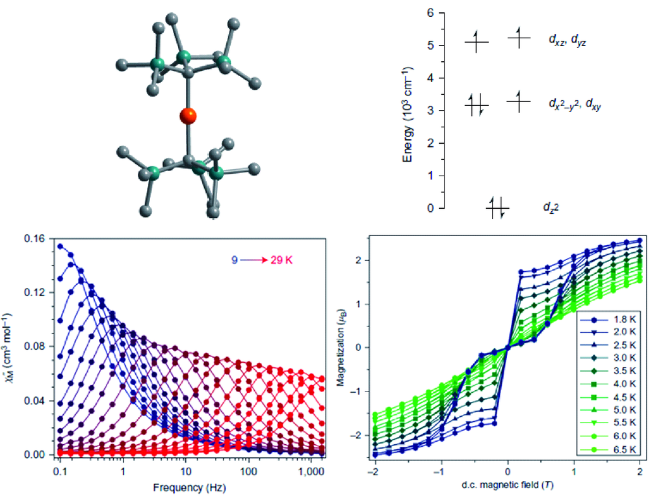
6 六配位的3d-SIMs
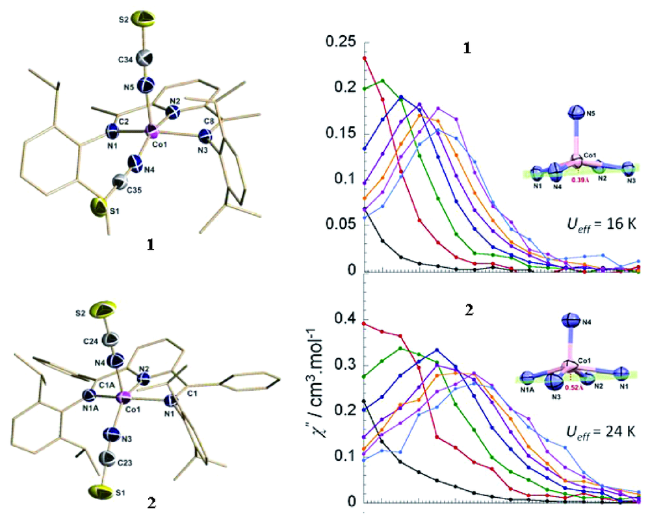
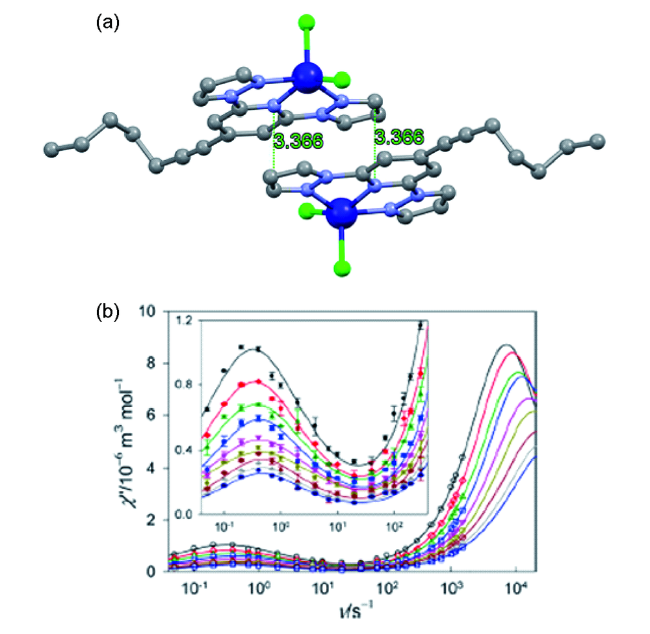
图7 (HNEt3)+(CoⅡCo3ⅢL6)-分子结构图(a)、能级分裂图(b)、三棱柱构型示意图(c)和虚部交流磁化率(d) [68]Fig. 7 (a) The molecular structure of(HNEt3)+(CoⅡCo3ⅢL6)-;(b) The simplified d7 electron configuration;(c) The coordination model of the central Co(Ⅱ) ion;(d) variable-frequency out-of-phase ac susceptibility data; inset, Arrhenius analysis of the relaxation processes [68] |
7 高配位数(七配位和八配位)的3d-SIMs
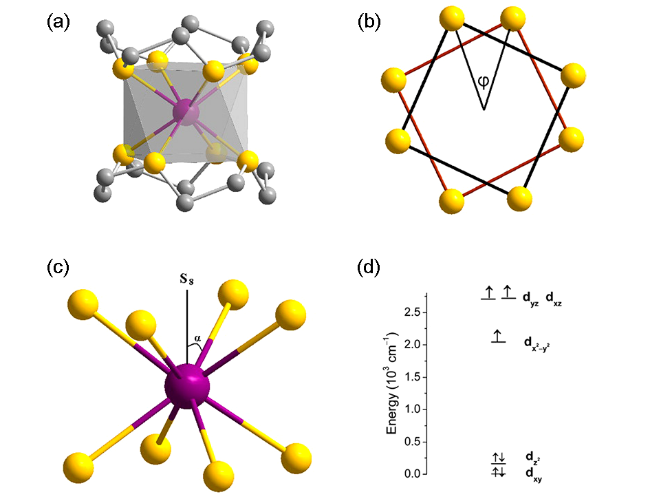
图9 [Co(12-crown-4)2]2+的结构示意图(a)、四方反棱柱上平面与下平面形成的扭转角φ示意图(b)、中心轴与配位键所形成的α示意图(c)、d轨道分裂图(d) [90]Fig. 9 (a) Side view of molecular structure of the cation [Co(12-crown-4)2]2+;(b) Twist angle φ defined as the rotation angle of one coordination square away from the eclipse conformation to the other;(c) The angle α defined as the eight metal-ligand bonds make with the S8 axis passing through the metal atom Co;(d) Electronic configuration and d-orbital energy level diagram for the molecule from DFT calculation [90] |