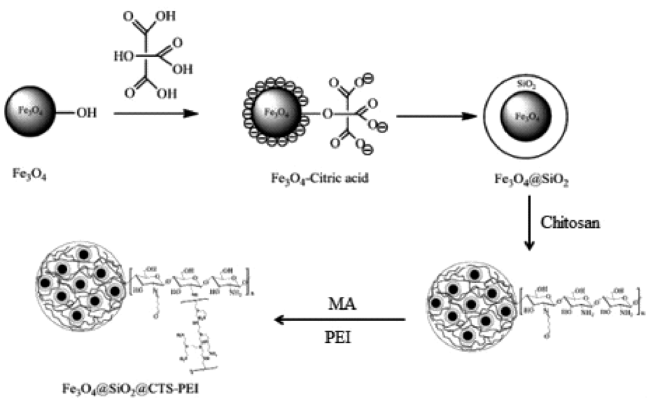
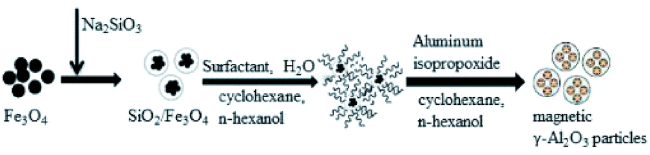
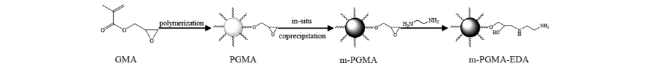
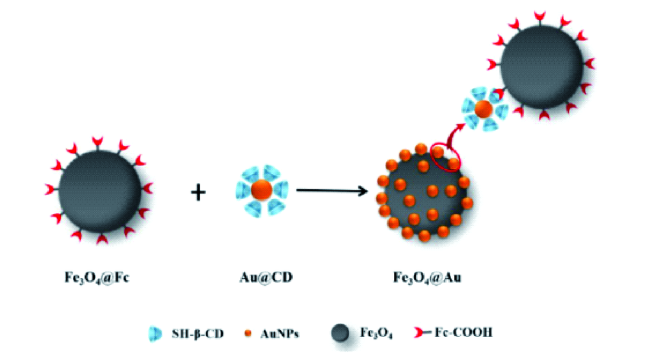
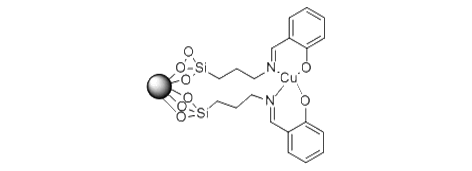
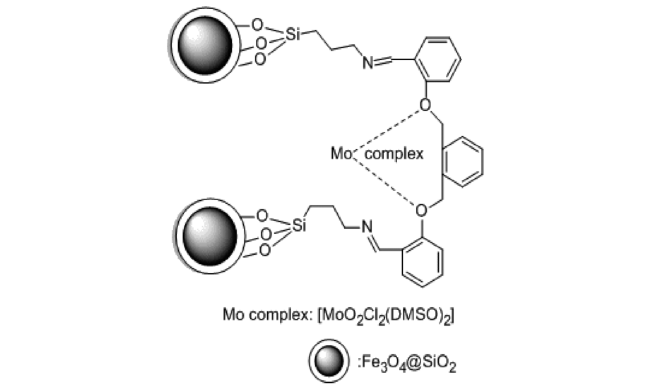
Zheng等
[69]使用两种不同的表面活性剂(十六烷基三甲基氯化铵CTAC和十六烷基硫酸钠SDS)来辅助样品合成,制备了具有磁性和催化活性的双功能催化剂MoS
2/SiO
2/Fe
3O
4,该催化剂具有核-壳结构,磁核平均直径约为50 nm,在300 K的温度下MoS
2/SiO
2/Fe
3O
4颗粒的饱和磁化强度为59 emu/g。与不加表面活性剂的样品实验对比,发现表面活性剂对最终催化剂的性质和活性有很大影响。表面活性剂可以通过为晶体生长提供合适的位点来加速其前体生成MoS
2的速度。催化剂的加氢脱硫(HDS)实验显示阳离子表面活性剂辅助制备的催化剂具有较高的活性。原因是SDS在合成温度200 ℃开始分解,在合成1 h内,几乎所有的SDS均分解,而TGA分析显示CTAC这种催化剂具有较强的磁性和较高的催化活性,并且易于通过磁场回收,使用寿命长,250 ℃才开始分解。Cat-CTAC在二苯并噻吩加氢脱硫中表现出最高的活性。然而,有人担心在含硫环境中使用这些复合材料以及作为含硫化催化剂的复合材料的稳定性。他们
[70]又以Fe
3S
4为磁核,CTAC作为表面活性剂在催化剂层上作为活性相,外层由(Ni/Co)MoS
2催化剂组成,然后以苯丙噻吩(DBT)和4,6-二甲基二苯并噻吩(4,6-DMDBT)作为模型含硫化合物测试加氢脱硫效果,并研究Ni和Co的促进作用。与MoS
2/Fe
3O
4对比,NiMoS/Fe
3S
4对DBT和4,6-DMDBT具有较高的催化活性。DBT的HDS中CoMoS/Fe
3S
4的活性和该催化剂的DDS/HYD比率与Ni促进的催化剂类似。MoS
2/Fe
3S
4显示出更高的HYD途径趋势,DDS/HYD比率为0.31。与MoS
2/Fe
3O
4复合材料相比,MoS
2/Fe
3S
4复合材料在HDS测试的几个循环中均表现出较高的稳定性,并且在前4个循环中表现出更高的加氢选择性。
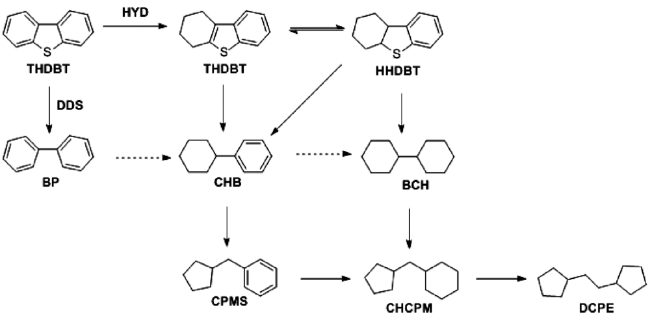
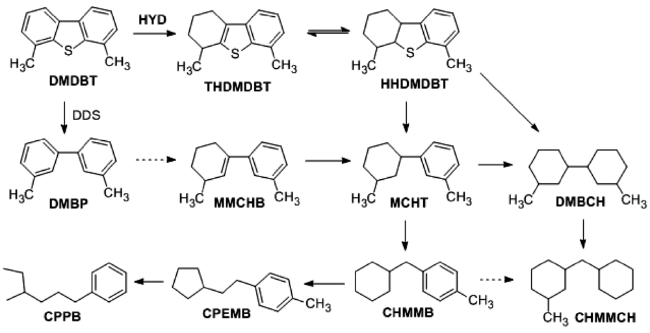
图7和
图8分别为DBT和4,6-DMDBT的HDS可能路线。