

膜受体介导双酚A低剂量内分泌干扰效应的分子机制
收稿日期: 2018-04-08
修回日期: 2018-07-03
网络出版日期: 2020-05-22
基金资助
中科院战略性先导科技专项(XDB01020300)
国家自然科学基金项目资助(21377158)
国家自然科学基金项目资助(21577149)
国家自然科学基金项目资助(21477139)
国家自然科学基金项目资助(21237005)
国家自然科学基金项目资助(21621064)
国家自然科学基金项目资助(21321004)
Mechanism of the Endocrine-Disruptive Effects of Low-Dose Bisphenol A via Transmembrane Receptor
Received date: 2018-04-08
Revised date: 2018-07-03
Online published: 2020-05-22
Supported by
The work was supported by the Strategic Priority Research Program of the Chinese Academy of Sciences(XDB01020300)
The National Natural Science Foundation of China(21377158)
The National Natural Science Foundation of China(21577149)
The National Natural Science Foundation of China(21477139)
The National Natural Science Foundation of China(21237005)
The National Natural Science Foundation of China(21621064)
The National Natural Science Foundation of China(21321004)
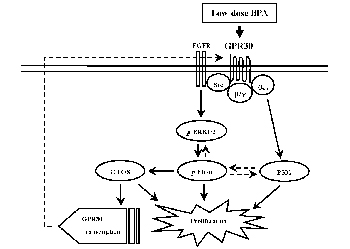
双酚A(Bisphenol A, BPA)为苯酚系衍生物,作为生产聚碳酸酯塑料和环氧树脂的中间体被广泛应用于多种产品制造中,为全球产量最大的工业品之一。BPA的大量应用使普通人群暴露BPA的几率显著增加。BPA结构与雌激素相似,为一典型雌激素样内分泌干扰物,可以对机体产生多种毒性效应。高剂量BPA主要通过拮抗雌激素受体而发挥其内分泌干扰效应;环境相关低剂量BPA由于不能与雌激素竞争结合雌激素受体,主要通过膜受体介导的信号通路以非基因组方式诱导细胞生物学功能改变。但是,具体何种膜受体介导BPA的低剂量效应以及相关分子机制目前还不清楚。基于此,我们课题组近年来在这些方面做了一系列工作。我们发现,膜G蛋白偶联受体30和整合素αvβ3及其介导的信号传导通路分别介导了环境相关低剂量BPA对雄性生殖细胞的增殖诱导和甲状腺素基因转录的干扰。对环境相关低剂量BPA作用机制的深入理解不仅有助于更客观真实评价和预测环境暴露BPA对人体健康的可能潜在影响以及采取有针对性的预防和干预措施。同时,也将为评价其他类似结构雌激素样环境内分泌干扰物的健康效应提供理论基础及技术支持。本文将结合我们近年来的研究工作,综述目前环境低剂量BPA暴露对人体健康影响的分子机制研究进展、存在的问题以及将来研究的一些思考。
朱本占 , 沈忱 , 盛治国 . 膜受体介导双酚A低剂量内分泌干扰效应的分子机制[J]. 化学进展, 2019 , 31(1) : 167 -179 . DOI: 10.7536/PC180414
Bisphenol A (BPA) is a phenol derivative and widely used in the manufacture of polycarbonate plastics and epoxy resins. It is one of the largest industrial products in the world. The extensive use of BPA makes it more easily exposed to the general population. BPA is believed to be a typical estrogen-like endocrine disruptor that can induce multiple toxic effects on the human body. High-dose BPA exerts its endocrine-disrupting effects mainly by antagonizing estrogen receptors (ERs); environmentally-relevant low-dose BPA cannot compete with estrogen for binding to ERs, and induces biological effects in a non-genomic manner mainly through the membrane receptor-mediated signaling pathways. However, it is still unclear which membrane receptor mediates the low-dose effect of BPA and the related molecular mechanisms. Based on this, our laboratory has done a series of work in these areas in recent years. We have found that membrane G protein-coupled receptor 30 and integrin αvβ3 and their mediated signaling pathways mediate the effects of environmentally-relevant low-dose BPA on the induction of male germ cells proliferation and the transcription of thyroid hormone genes, respectively. An in-depth understanding of the molecular mechanism of environmentally-relevant low-dose BPA will contribute to a more objective and realistic evaluation and prediction of the potential effects of environmental exposure on human health and then perform targeted prevention and interventions. Likewise, it will also provide a theoretical basis and technical support for evaluating the health effects of endocrine disruptors in other similar structural estrogen-like environments. This article combines our research work in recent years, reviews the current progress in the molecular mechanism of environmental low-dose BPA exposure on human health, existing problems, and some future research.

| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
ANSES (French Agency for Food, Environmental and Occupational Health Safety). 2013.
|
| [6] |
ANSES (French Agency for Food, Environmental and Occupational Health Safety). 2017.
|
| [7] |
ANSES (French Agency fo Food,Environmental and Occupational Health Safety). Mol. Cell.Endocrinol., 2018,ISSN 0303- 7207(18):30055.
|
| [8] |
ECHA(European Chemicals Agence). 2015.
|
| [9] |
EFSA (European Food Safety Authority). EFSA J, 2015,13:3978.
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
钱伯章 (
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
ANSES(French Agency for Food, Environmental and Occupational Health Safety). 2014.
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|
| [87] |
|
| [88] |
|
| [89] |
|
| [90] |
|
| [91] |
|
| [92] |
|
| [93] |
|
| [94] |
|
| [95] |
|
| [96] |
|
| [97] |
|
| [98] |
|
| [99] |
|
| [100] |
|
| [101] |
|
| [102] |
|
| [103] |
|
| [104] |
|
| [105] |
|
| [106] |
|
| [107] |
|
| [108] |
|
| [109] |
|
| [110] |
|
/
| 〈 |
|
〉 |