1 引言
为应对2019年12月以来爆发的新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)疫情,我国组织了一系列科研攻关和药物研发工作,并且通过出台新型冠状病毒肺炎诊疗方案指导我国新型冠状病毒肺炎病例诊断和医疗救治工作的开展。
截至2020年2月20日,国家卫生健康委员会已经发布六个版本的《新型冠状病毒肺炎诊疗方案》[1],这些方案中均提出可试用“洛匹那韦/利托那韦”进行抗病毒治疗,并在第六版中指出试用利巴韦林时建议与干扰素或“洛匹那韦/利托那韦”联合应用。这里的“洛匹那韦/利托那韦”是指洛匹那韦(Lopinavir)与利托那韦(Ritonavir)的复方制剂,即克力芝(Kaletra),是美国生物制药公司艾伯维研发的一种抗艾滋病药物,适用于与其他抗反转录病毒药物联合用药,一般用于治疗成人和2岁以上儿童的人类免疫缺陷病毒-1(HIV-1)感染。世界卫生组织在2013年将利托那韦/洛匹那韦列为3岁以下儿童一线抗逆转录病毒治疗药物,将利托那韦/洛匹那韦列为对成人和青少年进行二线抗逆转录病毒治疗的首选增强型蛋白酶抑制剂之一[2]。克力芝复方药物于2000年9月被美国FDA批准上市,并于2007年11月获批在中国上市[3],2009年其全球销量达到13.66亿美元,位居当年抗感染药销量首位[4]。在克力芝用于新冠肺炎治疗的研究进展方面,2020年2月3日国家卫生健康委员会报道“针对新冠肺炎,克力芝和中药治疗一些临床试验正在收集临床信息数据”[5];随后李兰娟[6]、陈军[7]、杨銘耀[8]、曹彬[9]、HUNG[10]、LIM[11]等学者相继发布了其围绕克力芝治疗新型冠状病毒肺炎开展研究所取得的研究进展。
鉴于克力芝复方药物对于新冠肺炎的潜在疗效,本文利用全球专利数据,基于专利计量分析方法,对克力芝的全球专利布局情况进行分析,揭示药物相关专利布局态势,反映我国在该药物研发上的专利布局特点,以期为我国药物研发攻关以及宏观决策提供支撑和启发。
2 数据及方法
2.1 数据来源及获取策略
本研究的数据来源于科睿唯安Cortellis药物数据库、美国国立卫生研究院PubChem数据库和合享新创Incopat专利数据库。数据获取策略分为三步:首先基于Cortellies数据库和PubChem数据库检索获取克力芝药物的关联专利数据,然后从Incopat专利库中补充检索克力芝的相关数据1(1 检索式:TIAB=(LOPINAVIR OR RITONAVIR OR 洛匹那韦 OR 洛匹那韦)),最后合并去重前两步的数据集,并利用Incopat专利库下载专利的详细著录项信息开展计量分析。数据的检索日期为2020年3月2日,合计获取专利536项2(2 1项专利是指1个专利族,即在多个国家或地区的知识产权机构同时提交专利申请的同一技术发明创造。本文利用Incopat数据库的简单同族合并功能对专利家族的归并。)。
针对分析药物专利技术布局的目标,本研究采用人工判读的方式对于克力芝专利所属的技术方向类别(包括化合物、组合物、晶型、制剂、制备工艺、用途)进行逐一判断和标注。
2.2 研究方法
本研究基于专利计量分析方法,从克力芝药物相关专利的布局时间分布、逐年专利布局技术方向、逐年专利申请国家分布、各国专利技术布局方向、专利申请人以及对华专利许可情况进行分析,揭示克力芝药物的专利布局态势。采用Excel、Python等工具软件进行可视化展示,从而直观展示分析结果。
3 克力芝药物专利分析
3.1 克力芝专利布局趋势
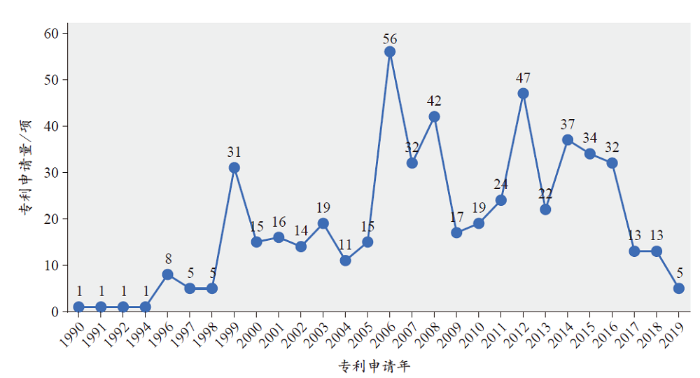
分析克力芝专利及其申请年度分布(图1)发现,以2006年为分水岭,其专利申请数量整体呈现先增长后逐步下降的趋势。首件专利申请于1990年,是雅培公司3(3 2013年,艾伯维公司从雅培公司中拆分出来独立上市,因此参考文献[2]中认为克力芝的专利技术由雅培公司布局。)申请的“逆转录病毒蛋白酶抑制化合物”专利,该专利在日本、美国、韩国、希腊、巴西等全球31个国家和地区均提交了专利申请,这体现了雅培公司对该技术的重视;随后在1991年、1992年和1994年,雅培公司又围绕该发明申请了药物的中间体、组合物以及用于HIV感染治疗的用途专利,这些专利构成了后续专利布局的基础核心专利,由于发明专利通常具有20年的保护期限,这些专利已经失效,但是后续围绕这些专利的外围专利不断被申请。随着2000年克力芝复方药物在美国FDA的获批上市,相关专利布局力度不断增加,在2006年达到峰值,后随着技术的日趋成熟,相关专利数量开始小幅度下降,尤其2014年之后,专利申请量的下降趋势愈发明显,这与药物的专利布局日趋完善存在一定的关系。
图1
3.2 逐年专利布局技术方向分析
分析克力芝逐年专利布局技术方向(见图2)发现,其在各技术方向上的专利布局时间大致按照“化合物专利先行布局,组合物和晶型专利追随布局,随后是制剂和制备工艺专利布局,用途类专利最后布局”的顺序进行,同时,化合物类专利以早期布局为主,组合物、晶型、制剂、制备工艺和用途类专利均呈现持续布局态势。
图2
具体来看,该药物在研发初始阶段(1999年之前)主要布局的是化合物类专利,这些专利主要由药物的研发公司雅培公司申请,但是化合物类的专利在2000年后布局数量显著减少,这可能是由于药物的基础研发创新已取得阶段性成果,基础化合物创新难度逐渐加大。在基础化合物专利的基础上,从1999年开始,专利布局转为组合物和晶型专利布局为主要技术方向,组合物主要是利用克力芝基础成分利托那韦和洛匹那韦与其他化合物或者物质形成的具有特定功效的组合物;晶型专利包括复式晶型、无定形晶型、多晶型等的发明创新。随后从2000年开始,制剂和制备工艺类专利开始萌芽并快速布局,在制剂类专利方面,从围绕口服用途的固体制剂专利开始,克力芝布局了片剂、散剂、颗粒剂、口腔速崩片以及相关调味系统等若干制剂专利;在制备工艺方面,主要是面向大规模工业化生产,提出的简化工艺流程简单、缩短生产周期、提高合成收率、提升安全性能的技术发明方案。从2001年开始,克力芝的新用途专利开始布局,2001申请的第一件新用途专利围绕利托那韦在Ⅰ型糖尿病、多发性硬化症、丙型肝炎病毒和癌症等疾病的治疗用途,后续在2006年、2012年和2015年布局的大量用途专利申请主要围绕HCV丙型肝炎的治疗用途。此外,还涉及HDV丁型肝炎、胃肠疾病、其他抗肿瘤药物引起腹泻所导致的肠功能障碍、良性增生性疾病、肥胖、II型糖尿病、糖尿病肾病、非酒精性脂肪肝、宫颈疾病等疾病的治疗用途。
3.3 逐年专利申请国家/地区分布
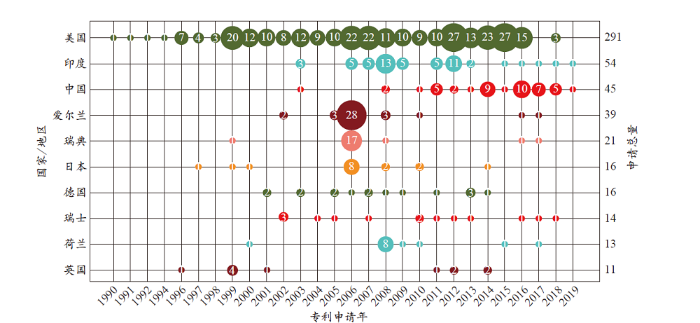
截止到检索日,合计27个国家/地区进行了克力芝专利申请,通过对TOP10国家/地区4(4 其余17个克力芝专利申请国家/地区分别是法国、俄罗斯、泰国、以色列、巴西、意大利、新西兰、加拿大、韩国、新加坡、匈牙利、希腊、古巴、澳大利亚、中国香港、阿根廷和塞浦路斯。)的专利申请年度分布(图3)分析发现,美国相关专利申请数量最多,达291项,占专利申请总量的54.3%,从1990年开始专利申请较为持续基本未出现中断;印度的专利申请量排名全球第2,其专利申请从2003年开始,最早的专利申请是兰贝克赛实验室有限公司申请的一种含有红霉素A或其衍生物和藻酸的药物组合物,该组合物中可以包含利托那韦等活性成分来发挥作用,2013年印度的专利申请量达到峰值。中国的专利申请数量排名第3,最早的专利申请是厦门大学2003年申请的一种合成利托那韦的方法,通过创新制备方法来提升原子利用率,从2010年开始专利申请持续布局,并于2016年达到峰值(10项)。排名第4、5、6位的爱尔兰、瑞典和日本均在2006年布局了较多专利申请,爱尔兰泰博特克药品有限公司和瑞典美迪维尔公司布局了丙型肝炎病毒的治疗用途专利,日本烟草产业株式会社(与美国吉利德公司合作)申请了一系列改善HIV整合酶抑制剂的药物动力学的方法专利。德国、瑞士、荷兰和英国的专利申请量排在第7到10位,专利申请间断较大,未呈现连续布局的状态。
图3
3.4 各国/地区专利技术布局方向
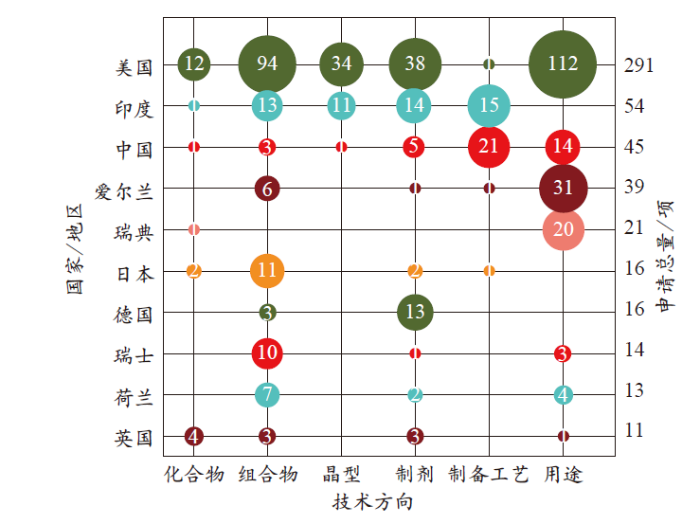
进一步分析克力芝专利申请TOP10国家/地区的专利技术布局方向(见图4)发现,美国在克力芝化合物、组合物、晶型和用途专利申请数量方面均是全球首位,具有较为明显的专利储备优势;中国在制备工艺专利申请数量上优势明显,但是基础化合物及晶型专利申请不足,唯一的化合物专利是中国科学院生态环境研究中心在2017年申请的“具有抗HIV-1活性的Ritonavir硒唑衍生物及合成方法”,此外中国还围绕克力芝基础成分利托那韦和洛匹那韦的新用途布局了较多用途专利;专利申请量排名第2位的印度的专利申请主要分布在组合物、晶型、制剂和制备工艺技术上,尤其在晶型专利的申请上仅次于美国且明显领先于其他国家和地区;爱尔兰和瑞典的专利申请主要集中在用途专利的申请,且仅次于美国,优势较为明显;日本、瑞士和荷兰的专利申请主要围绕药物组合物,德国主要围绕制剂专利申请,英国的专利申请在化合物、组合物和制剂方面均有专利储备,但是规模相对较小。
图4
3.5 专利申请人分析
克力芝药物的专利申请人涉及324家机构和个人,分析TOP20专利申请机构分布(表1)发现,美国艾伯维公司及其拆分前母公司雅培是洛匹那韦/利托那韦的主要申请人,合计申请187项,专利覆盖化合物、组合物、晶型、制剂、制备工艺、用途所有技术方向;爱尔兰的泰博特克药品有限公司的专利申请数量排名第3位,布局了用途、组合物、制剂和制备工艺四类专利;瑞典的美迪维尔公司位居第4位,主要围绕药物用于丙型肝炎治疗申请了较多的用途专利;美国的吉利德公司和瑞士的罗氏公司分别位居第5位和第6位,均申请了较多药物组合物类专利。
表1 克力芝TOP20专利申请机构
| 排序 | 专利申请人 | 国家/地区 | 专利申请量/项 | 占比 | 技术方向及其专利申请量 |
|---|---|---|---|---|---|
| 1 | 艾伯维公司 | 美国 | 113 | 21.08% | 用途:79, 制剂:14, 晶型:11, 组合物:9 |
| 2 | 雅培公司 | 美国 | 74 | 13.81% | 组合物:26, 制剂:21, 晶型:17, 化合物:5, 用途:4, 制备工艺:1 |
| 3 | 泰博特克药品有限公司 | 爱尔兰 | 36 | 6.72% | 用途:28, 组合物:6, 制剂:1, 制备工艺:1 |
| 4 | 美迪维尔公司 | 瑞典 | 21 | 3.92% | 用途:20, 化合物:1 |
| 5 | 吉利德公司 | 美国 | 20 | 3.73% | 组合物:16, 用途:2, 化合物:1, 晶型:1 |
| 6 | 罗氏公司 | 瑞士 | 14 | 2.61% | 组合物:11, 用途:3 |
| 7 | 滨州医学院 | 中国 | 12 | 2.24% | 用途:12 |
| 8 | 印度熙德隆制药公司 | 印度 | 11 | 2.05% | 晶型:7, 组合物:4 |
| 9 | 日本烟草产业株式会社 | 日本 | 9 | 1.68% | 组合物:8, 化合物:1 |
| 10 | 艾格尔峰生物制药有限公司 | 美国 | 9 | 1.68% | 用途:6, 组合物:3 |
| 11 | 印度兰伯西制药有限公司 | 印度 | 8 | 1.49% | 制备工艺:4, 晶型:2, 组合物:1, 化合物:1 |
| 12 | 希普拉有限公司 | 印度 | 7 | 1.31% | 组合物:6, 制剂:1 |
| 13 | 阿尔迪默菲克斯技术有限责任公司 | 荷兰 | 6 | 1.12% | 组合物:5, 制剂:1 |
| 14 | 葛兰素集团 | 英国 | 6 | 1.12% | 化合物:4, 组合物:2 |
| 15 | 印度 MATRIX LABORATORIES LIMITED公司 | 印度 | 6 | 1.12% | 制剂:4, 制备工艺:2 |
| 16 | 迪赛诺公司 | 中国 | 6 | 1.12% | 制备工艺:6 |
| 17 | 强生公司 | 美国 | 5 | 0.93% | 用途:4, 组合物:1 |
| 18 | 辉瑞公司 | 美国 | 5 | 0.93% | 组合物:4, 化合物:1 |
| 19 | 东北制药集团股份有限公司 | 中国 | 4 | 0.75% | 制备工艺:4 |
| 20 | 利物浦大学 | 英国 | 4 | 0.75% | 制剂:3, 组合物:1 |
TOP20申请机构中包括3家中国机构,分别是滨州医学院(排名第7位)、迪赛诺公司(排名第16位)和东北制药集团股份有限公司(排名第19位),其中滨州医学院是我国围绕克力芝药物专利申请最多的机构,但是其专利申请均是围绕该药物的新用途,如急性肺损伤/急性呼吸窘迫综合征、肺纤维化、缺血性心脑血管疾病、肥胖、II型糖尿病、糖尿病肾病和非酒精性脂肪肝方面的用途。迪赛诺公司和东北制药集团股份有限公司的专利均是围绕药物的制备工艺布局,是应对大规模工业化生产药物而提出的制备技术方案。因此,我国在该药物的专利申请比较侧重药物的生产和应用,药物基础化合物、组合物的专利成果产出相对薄弱。
4 结论与分析
本文以克力芝(洛匹那韦/利托那韦)药物为研究对象,利用Cortellies药物数据库、PubChem数据库和Incopat专利数据库的专利数据,基于专利计量分析方法,从克力芝专利布局时间分布、逐年专利布局技术方向分析、逐年专利申请国家分布分析、各国专利技术布局方向分析、专利申请人分析以及对华专利许可情况分析几个角度展示了克力芝药物的专利布局态势,得到如下结论。
(1)全球克力芝专利申请数量整体呈现先增长后逐步下降的趋势,在布局技术方向上按照“化合物——组合物和晶型——制剂和制备工艺——用途”的顺序进行布局,目前的技术研发已经相对趋于成熟,2006年后的专利申请主要围绕药物制剂、新用途和制备工艺。
(2)克力芝的化合物专利是基础核心专利,主要由美国雅培公司在2000年之前申请,首件基础专利申请于1990年,是雅培公司申请的“逆转录病毒蛋白酶抑制化合物”专利,该专利同时在全球25个国家/地区进行了专利保护,显示了雅培公司较强的知识产权保护意识。由于专利20年的保护期限,这些基础化合物专利现已失效,但是后续的专利申请一直在持续进行。
(3)美国是洛匹那韦/利托那韦药物相关专利的主要布局国,美国艾伯维公司及其拆分前母公司雅培是洛匹那韦/利托那韦的主要持有者,该公司的专利布局从时间维度上看从未间断,从地域分布看基础核心专利在多个国家同时要求权利保护,从覆盖范围看涉及化合物、组合物、晶型、制剂、制备工艺、用途所有技术方向,建立了较为全面的专利布局和明显的技术优势。印度的相关专利申请全球排名第二,专利主要围绕组合物、晶型、制剂和制备工艺技术。
(4)我国的滨州医学院、迪赛诺公司和东北制药集团股份有限公司等机构围绕克力芝药物已经进行了一定的专利布局,但是主要围绕制备工艺和新用途,基础化合物专利申请较为薄弱,尽管药物的部分基础化合物专利已经到期失效,但是在制备和应用药物时仍有较多外围专利保护可能形成阻力或壁垒。
参考文献
关于印发新型冠状病毒肺炎诊疗方案(试行第六版)的通知
[EB/OL]. [
国家卫健委回应“新冠肺炎”药物进展:克立芝、中药等正在收集临床数据
[EB/OL]. [
李兰娟院士团队发布:这两种药能有效抑制新型冠状病毒
[EB/OL]. [
A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe COVID-19
[J].BACKGROUND: No therapeutics have yet been proven effective for the treatment of severe illness caused by SARS-CoV-2. METHODS: We conducted a randomized, controlled, open-label trial involving hospitalized adult patients with confirmed SARS-CoV-2 infection, which causes the respiratory illness Covid-19, and an oxygen saturation (Sao2) of 94% or less while they were breathing ambient air or a ratio of the partial pressure of oxygen (Pao2) to the fraction of inspired oxygen (Fio2) of less than 300 mm Hg. Patients were randomly assigned in a 1:1 ratio to receive either lopinavir-ritonavir (400 mg and 100 mg, respectively) twice a day for 14 days, in addition to standard care, or standard care alone. The primary end point was the time to clinical improvement, defined as the time from randomization to either an improvement of two points on a seven-category ordinal scale or discharge from the hospital, whichever came first. RESULTS: A total of 199 patients with laboratory-confirmed SARS-CoV-2 infection underwent randomization; 99 were assigned to the lopinavir-ritonavir group, and 100 to the standard-care group. Treatment with lopinavir-ritonavir was not associated with a difference from standard care in the time to clinical improvement (hazard ratio for clinical improvement, 1.31; 95% confidence interval [CI], 0.95 to 1.80). Mortality at 28 days was similar in the lopinavir-ritonavir group and the standard-care group (19.2% vs. 25.0%; difference, -5.8 percentage points; 95% CI, -17.3 to 5.7). The percentages of patients with detectable viral RNA at various time points were similar. In a modified intention-to-treat analysis, lopinavir-ritonavir led to a median time to clinical improvement that was shorter by 1 day than that observed with standard care (hazard ratio, 1.39; 95% CI, 1.00 to 1.91). Gastrointestinal adverse events were more common in the lopinavir-ritonavir group, but serious adverse events were more common in the standard-care group. Lopinavir-ritonavir treatment was stopped early in 13 patients (13.8%) because of adverse events. CONCLUSIONS: In hospitalized adult patients with severe Covid-19, no benefit was observed with lopinavir-ritonavir treatment beyond standard care. Future trials in patients with severe illness may help to confirm or exclude the possibility of a treatment benefit. (Funded by Major Projects of National Science and Technology on New Drug Creation and Development and others; Chinese Clinical Trial Register number, ChiCTR2000029308.).
Triple combination of interferon beta-1b, lopinavir-ritonavir, and ribavirin in the treatment of patients admitted to hospital with COVID-19: an open-label, randomised, phase 2 trial
Case of the Index Patient Who Caused Tertiary Transmission of COVID-19 Infection in Korea: the Application of Lopinavir/Ritonavir for the Treatment of COVID-19 Infected Pneumonia Monitored by Quantitative RT-PCR