有关生物类似药机会的问题,监管层和生物制药行业已经谈论了十多年。如今,市场价值约1 000亿美元的生物药,包括多年占据全球畅销药首位的修美乐(Humira),将在未来几年里失去在美国和欧洲的关键专利保护;仅在美国,到2021年,预计将有70多个生物药专利到期。生物类似药的机会比以往任何时候都要更加巨大。
生物类似药令人兴奋的原因在于,它们有可能节省医疗成本;但是在不同的市场,节省下的费用是不同的。例如,在美国,只有3个生物类似药获批上市——山德士公司(Sandoz)的Zarxio(非格司亭),参照药是安进公司的Neupogen(优保津),另外2个生物类似药的参照药都是杨森(Janssen Biotech)公司的类克(Remicade,英夫利昔单抗)。在美国获得批准的首个类克的生物类似药是Inflectra,这个药和Zarxio的定价都是原研药品的85%。而为了提前应对类似药的竞争,原研生物药的价格一直在逐年提高。所以,当前的生物类似药即使有折扣,其价格比前些年的原研药的价格还要高。因此,Celltrion Healthcare和辉瑞(Pfizer)合作开发的Inflectra上市6个多月,仅仅使得原研药类克在美国的销售额下降5%。
美国FDA局长Scott Gottlieb也承认,“我们中的许多人已经对生物类似药能够节省的费用如此有限感到失望。”怀俄明州共和党参议员Michael Enzi也同意此观点,他指出,美国生物类似药的开发速度缓慢。
不过,随着更多的生物类似药推向市场,这种失望有可能消除。2017年7月,FDA批准了第2个类克的生物类似药——Samsung Bioepis公司和默沙东公司合作开发的Renflexis,其定价比原研药低了35%。这个价格对类克和Inflectra都构成了挑战。
表1 FDA批准的生物类似药*
| 商品名 | 通用名 | 研制机构 | 参照药 | 参照药开发商 | 批准时间 | 上市时间 |
|---|---|---|---|---|---|---|
| Zarxio | filgrastim-sndz | 山德士 | 优保津 (Neupogen) | 安进 | 2015年3月 | 2015年9月 |
| Inflectra | infliximab-dyyb | Celltrion(授权给辉瑞) | 类克(Remicade) | 强生 | 2016年4月 | 2016年11月 |
| Erelzi | etanercept-szzs | 山德士 | 恩利(Enbrel) | 安进 | 2016年8月 | 等待专利过期 |
| Amjevita | adalimumab-atto | 安进 | 修美乐(Humira) | 艾伯维 | 2016年9月 | 等待专利过期 |
| Renflexis | infliximab-abda | Samsung Bioepis (授权给默沙东) | 类克(Remicade) | 强生 | 2017年4月 | 2017年7月 |
* 截至2017年8月1日
来源:FDA
截至2017年8月1日,FDA已经批准了5个生物类似药,但是原研方的专利使得其中的2个药物还无法进入市场——安进的Amjevita(艾伯维公司的修美乐的生物类似药)和山德士公司的Erelzi(安进公司的依那西普的生物类似药)。另外还有2个生物类似药通过505(b)(2)途径获得批准进入市场——山德士公司的Omnitrope(生长激素)和礼来公司的Basaglar(甘精胰岛素)。这两个药的折扣大约是15%。
在欧盟,生物类似药市场令人鼓舞。欧盟是全球首个为生物类似药建立正式审批途径的监管机构。截至2017年5月31日,欧盟已经批准了28个生物类似药,其中的绝大多数已上市销售,提供的折扣率约为30%。在一些采用竞争性招标的国家,或者同一参照生物药有多个生物类似药存在的情况下,折扣力度会更大。
俄罗斯圣彼得堡CJSC Biocad公司的研发和国际业务拓展副总裁Ivan Romanov表示,在俄罗斯,某个特定生物药的首个生物类似药的价格一般比原研产品低20%~30%。这个折扣率通常会保持稳定,直至第二个生物类似药进入市场。进一步的竞争可以使得折扣最高达到参照的原研药价格的20%。
直接节省费用并不是生物类似药带来的唯一好处。除了提供优惠的价格外,生物类似药还可以对创新药,甚至整个同类别药物的价格进行控制。在欧盟,不断加剧的来自生物类似药的竞争正在推动整个生物药的价格下跌,使患者更容易获得这类药物。俄罗斯和其他发展中国家也呈现出类似的趋势。在这些地区,过去,原研生物药的奇高定价使其成为只有少数患者负担得起的奢侈品。
据市场研究公司艾美仕(IMS)的报告,在罗马尼亚,2016年,非格司亭的定价比首个生物类似药上市那年的价格下跌了62%,而使用量随之增长了2 542%。在斯洛伐克,非格司亭的价格下降了61%,使用量增长了509%。即使在生物类似药上市前非格司亭使用量已经很大的挪威,生物类似药还是推动了药物的使用量增长了164%。
抗TNF类药物英夫利昔单抗的生物类似药进入欧洲市场时也表现出了类似的趋势。在保加利亚降价23%的类似药推动其使用量增长了190%。在瑞典,原研药的使用率已经很高,但是39%的降价幅度还是导致了74%的使用增长。
除了节省费用和扩大可及性,生物类似药还为新兴市场国家提供了一个发展本国生物药产业的经济机会,使这些公司在将来的某一天有可能成长为区域性、甚至全球性的生物类似药开发商——印度就是这样成为全球最大的仿制药生产国之一。
随着生物类似药在欧盟变得越来越普遍,并开始在美国取得成功,一些公司开始设法在其产品线中增加生物类似药。与此同时,一些早期的生物类似药公司正在退出,而选择专注于创新药。创新药开发商、其他生物类似药开发商、监管机构和支付方所带来的开发和市场挑战通常会左右这些公司的决定。
作为针对生物类似药开发和市场地位的持续报道的一部分,BioWorld主办了多次网络研讨会,由顶尖的生物制药公司分享了其在欧盟、俄罗斯和美国市场开发生物类似药的经验。本报告基于上述会议的内容,结合后续的参会反馈和业界访谈编纂而成。
什么是生物类似药?
虽然在不同的市场,生物类似药的概念基本一致,但是因为各国的监管途径、临床试验要求、专利过期情况、定价和市场情况不同,导致这类药物的开发、生产和销售在各国有所不同。这些问题会限制或扩大生物类似药在特定市场的机会。
不考虑监管途径,生物类似药的概念对于全球的医生和患者来说还是有些困扰,很多人不理解生物药和小分子药物的区别,更不用说区分仿制药和生物类似药了。对于政府招标和可自动替代的市场,这不是障碍,但是,当处方医生和患者需要对药物使用有更多了解时,这种困惑会影响到生物类似药的使用。而且在类似美国这样的市场,至少在理论上,生物类似药的自动替代是不允许的,当原研药的品牌名称因为多年的公众推广已经家喻户晓时,缺乏相关的了解会成为生物类似药进入市场的阻碍。
在这样的市场,宣传至关重要。为了将生物类似药推向市场,一些制药公司,特别是在欧盟和美国市场的制药公司,正投入部分精力在其网站上解释什么是生物类似药,宣传它们的生物类似药是如何开发和生产的。FDA和其他一些监管机构也分担起教育的责任,创建面向公众的在线资源,建立公众对生物类似药的信心。欧洲药品局(EMA)和欧盟委员会最近发布了一个指南,帮助医疗专业人员了解生物类似药的科学和监管基础知识。世界卫生组织(WHO)也积极加入,与一些国家合作,开展生物类似药的宣传工作,并对联合国采购的属于基本生物药的生物类似药进行资格预审。毕竟,如果没有人使用生物类似药,就谈不上节省费用。
监管机构正在传递一个清晰的信息:生物类似药不是仿制药,因为它们不是完全复制它们所参照的大型复杂分子。它们也不是模仿创新(me-too)药,可以通过传统的临床开发计划评估安全性和有效性。与此相反,大多数监管机构要求生物类似药遵循证据的总体性(totality-of-the evidence),采用逐步的方法来展示其与所参照的生物药具有高度的科学相似性。一旦相似性被建立,那么科学推理就是,这个生物类似药与原研药具有相同的安全性和有效性。
那么,生物类似药和仿制药有什么区别呢?要回答这个问题,首先必须了解小分子药物和生物药之间的区别。顾名思义,小分子就是分子量小的分子。因为这类分子的结构相当简单、稳定和明确,所以易于表征和复制。小分子药物可以通过使用可预测过程的化学合成来进行生产,所以,可以通过反向工程来开发出确切的仿制药。
而与之对应,生物药是复杂的分子,它们比小分子要大数百倍。图1比较了阿司匹林和单克隆抗体的大小。生物药通常由相关分子的混合物组成,其蛋白来源于活体,如酵母、细菌或人体、动物或植物的细胞,因此被称作生物药。生物药通常不能被完全表征,且对外部条件敏感。因此,即便是原研方,也不可能确保这一批药物和下一批完全相同。
图1
生物类似药的开发
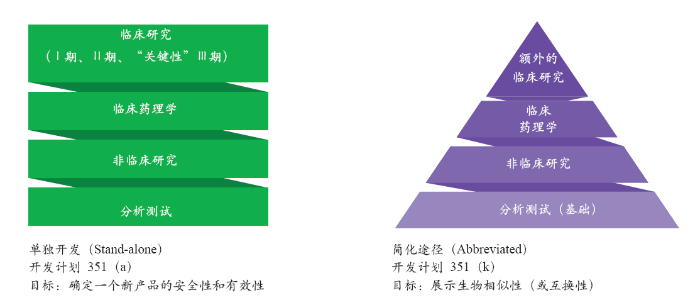
虽然小分子药物和生物药的生产工艺不同,但是两者的研发都遵循同样的基本步骤——发现,临床前开发,然后是完整的临床计划,包括在健康人群中的测试、剂量研究以及关键性随机对照试验,用以证明安全性和疗效。
生物类似药的开发与仿制药有很大的不同,尤其在高度监管的市场,如澳大利亚、加拿大、欧盟、日本和美国。对一个小分子药物进行反向工程以后,一家公司通常可以在实验室里证明它的仿制药具有生物等效性,仅需要非常少的临床开发过程。在大多数国家,仿制药可以自动替代参照药。简而言之,仿制药是复制现有的药物,不需要经历原研厂商需要的全部研发过程,可以跳过昂贵的临床试验,不必进行市场需求推广工作。因为开发和营销成本的降低,第一个上市的仿制药通常定价是品牌药的大约50%。当市场上有多个仿制药的时候,折扣率可以达到80%~90%,这时原研药经常会选择退出市场。
与仿制药和原研药相同,生物类似药的开发也始于实验室。由于生物类似药必须尽可能地模仿所参照的生物药,对于生物类似药的开发商来说,临床前分析是基础步骤。用FDA的话说,分析实验的很大一部分是为了从参照药中“获取尽可能多的科学”,从而更加全面地了解参照药的特性和作用机理。韩国Celltrion公司的市场、公共关系和医学事务负责人Ho-Ung Kim说,在开发Remsima 这一英夫利昔生物类似药的过程中,Celltrion进行了超过20次物理化学检测和超过40次的生物学测试。
与仿制药不同,生物类似药通常需要进行临床开发,以显示其与原研药在免疫原性、药效学(PD)和药代动力学(PK)上的高度相似性。在美国,生物类似药和它的原研参照药可以在临床无效成分上存在微小的差异,但两者在安全性、纯度和药效上不能有任何“临床意义上的差异”。
图2
无论是原研生物药还是生物类似药,因为它们的分子大小和敏感性的原因,都可能引发不想要的免疫反应。美国安进公司生物类似药副总裁兼总经理Scott Foraker谈到,生产工艺和患者的免疫系统都可能影响免疫反应的发生。与所有的生物药相同,FDA会评估生物类似药相关的免疫原性,作为批准流程的一部分。
Foraker表示,一般来说,FDA要求生物类似药的开发商完成以下工作。
 比较性PK或PD评估,以展示它们的候选药与参照生物药之间具有相似的药物暴露和相似的PK/PD关系;
比较性PK或PD评估,以展示它们的候选药与参照生物药之间具有相似的药物暴露和相似的PK/PD关系;
 至少开展一项临床研究,以评估免疫原性;
至少开展一项临床研究,以评估免疫原性;
 一项比较性临床研究,旨在支持证明候选药与参照生物药之间无临床意义的差异。
一项比较性临床研究,旨在支持证明候选药与参照生物药之间无临床意义的差异。
Foraker说,“创新药物开发需要3个临床研究阶段,通常每个阶段需要开展多项研究。”与之相比,生物类似药的临床开发是基于深入的分析,以证明其与参照生物药的结构和功能的相似性,由于对参照药物的深入了解,这个过程可以简化。
Foraker表示,当实际开发一个生物类似药的时候,临床开发的要求因不同的监管机构而异,不过,一般来说,“需要两个阶段的临床研究——一项Ⅰ期研究来证明具有相似的药代动力学(药物如何在体内移动)和药效学(药物在体内的作用),和一项关键性研究(Ⅲ期)来证明其与参照生物药具有相似的疗效、安全性和免疫原性。”
高度监管的市场还需要进行头对头、等效性或非劣性试验,将生物类似药与原研药进行比较。虽然新兴市场也可能需要进行临床试验,但并不总是坚持要开展头对头试验。不同监管机构对于生物类似药所要求的标准也有所不同。Foraker说,“在美国、欧洲、日本、加拿大和澳大利亚,监管机构要求……详尽的分析(实验室测试)、毒理(动物测试)和临床数据,包括药理学(人体测试)数据,来证明生物类似药和参照药之间的‘高度相似性’。”
然而,当涉及到批准和生物相似性时,基于不同监管机构对数据的解释,它们可能会做出不同的决定。Foraker说,“生物类似药的科学相当复杂,通常需要匹配大约100个必须的关键属性来显示生物相似性。”这些属性涉及到参照生物药的一般特性,它的一级机构、高阶结构、生物学特性、产品相关的物质和杂质,工艺相关的杂质、颗粒物和聚集体,以及遇热强制降解等因素。
Foraker说,“因为希望生物类似药与参照药达到高度相似,而不是完全相同,所以不会要求生物类似药的开发商必须‘击中靶心’来证明生物相似性;它只需要在目标范围之内确保高度相似性,而且‘没有临床意义上的’差异就可以。”因此,开发商将会根据特定市场监管机构的要求,生产产品属性在可接受范围内的生物类似药。在美国,通常会依据对称的劣性和优性边际制定等效研究方案。
安进公司的修美乐的生物类似药,在美国以Amjevita的商品名获得批准,其与美国批准的修美乐有91个属性匹配。在欧洲,这个生物类似药以Amjevita和Solymbic的商品名获批,与欧盟批准的修美乐有93个属性匹配。两者之间有极少数属性不匹配——在美国和欧洲分别是4个和2个——监管机构并不认为这几个不匹配的属性有临床意义。
Biocad的Romanov说,虽然对于开发商来说,预先知晓生物类似药与其参照生物药必须匹配的关键属性的清单会很有帮助,但是监管机构倾向于仅仅提供这些关键属性的粗略指南。在美国,FDA简报中揭示了其认为相关的关键属性,并且鼓励开发商在开发阶段尽早与FDA展开交流。但是,Romanov认为,由于没有监管机构提供属性的列表,每家生物类似药的开发商只能自行开展风险评估,定义参照生物药的关键质量属性,以用于开展比较性研究。
不同地区对于生物类似药所需要开展的临床试验的要求也有所不同,很多发展中国家都需要在当地进行试验。而在有些地区,如果这个生物类似药已经在欧盟或美国获得批准,可以不需要开展临床试验。Romanov指出,俄罗斯和印度就是这样。因为需要在多个地区开展深入的分析实验和临床试验,所以,相对于开发仿制药来说,开发生物类似药需要投入高得多的成本和时间。而且,与仿制药不同,获得批准的生物类似药还将面临营销成本,因为一些国家并不允许生物类似药与被处方的参照药之间自动替代,生物类似药生产商必须像推广原研生物药一样推销它们的产品。
表2 开发和生产的比较
| 仿制药 | 生物类似药* | 生物药 | ||
|---|---|---|---|---|
| 开发 | 科学性的困难 | 低(生物等效性) | 生物等效性 | 高 |
| 时间 | 短(3~4年) | 约8年 | 长(10~15年) | |
| 费用 | 低(<500万美元) 通常不需要临床研究 | 约2亿美元,通常需要临床研究 | 高(最高达25亿美元) 需要完整的临床研究 | |
| GMP | 生产工艺 | 简单,时间短 | 复杂 | 复杂,时间长 |
* 在美国,开发具有可互换性的生物药与开发生物类似药相比,开发费用更高,所需时间更长。
来源:BioWorld
在一些新兴市场,生物类似药的审批途径正在发展中,这使得竞争环境不均衡,可能会影响到未来几年的竞争态势。Romanov说,在过去,在一些地区,“仿制生物药”可以在无需临床数据的情况下获得批准。仿制品的出现使得价格降低了数倍,从而促进了它们的使用。虽然现在大多数市场已经引入了欧盟和WHO的生物类似药批准要求,但是,那些老旧的、更加廉价的、不符合这些标准的仿制品仍然在使用,对真正的生物类似药构成了挑战,因为后者必须承担临床开发的费用。
比如,Romanov谈到,在2010年9月以前,在俄罗斯,临床试验并不是“仿制生物药”获得批准的强制要求,而在此之后,俄罗斯要求所有的“仿制生物药”都需要提供比较性非临床和临床数据,但是仍旧缺乏生物类似药的定义和开发指南。因此,Romanov表示,与现在的规定相比,开发商有更大的自由来设计非劣性试验,这使得这些临床试验样本量更小,临床开发的成本更低,而相似性的标准却变得难以界定。
2014年底,俄罗斯修订了法律,生物类似药要获得上市授权,需要有比较安全性、有效性和免疫原性的数据。这些变化使得俄罗斯的生物类似药的审批途径与欧盟和美国更一致。2016年,俄罗斯和其他欧亚经济共同体(EEC)成员国接受了通用的生物药注册指南,其中包括生物类似药。Romanov表示,EEC的指南与EMA、WHO和国际人用药品注册技术协调会(ICH)的要求完全一致,而之前获得批准的生物类似药的生产商将有10年的时间来适应新的要求。同时,根据新标准开发的生物类似药将不得不与以前按照更宽松标准批准的同类产品进行竞争。
根据新标准,EEC的分析可比性要求包括,在多个商业化的批量生产上使用正交的方法和数据。在临床开发上,很多机构都要求体内PK、毒理和免疫原性研究。Romanov说,虽然EEC的PK可比性要求与欧盟的要求一致,但是大多数国家的监管机构不允许并行开展Ⅰ期和Ⅲ期试验。
在EEC,Ⅲ期研究需要进行比较疗效的研究。对于生物类似药来说,等效性试验被予以推荐,但是非劣性设计也可以因适当的理由而被接受。开发商可以与监管机构协商确定可接受的尺度。
什么是“可互换性”?
美国向生物类似药开发商提出了独特的挑战,因为该国规定生物类似药可以通过两种不同的途径获得批准。根据2010年通过的《生物制品价格竞争和创新法案》(BPCIA),FDA可以基于生物类似药途径,或者基于可互换性,来批准生物类似药上市。若按照生物类似药途径,药物与参照药物之间必须无临床意义的差异。而可互换性则必须证明,对于给定患者,药物与参照生物药能产生同样的临床结果。换句话说,具可互换性的生物类似药和参照生物药之间的互换,所造成的安全或疗效风险不能够大于持续使用参照药的风险。
Oncobilogogics的董事长、CEO和总裁Pankaj Mohan表示,因为这个标准,一个可互换的生物类似药可以自动地在美国的药房被替换,使其在销售时更像一个仿制药。但是,获得可互换性的批准需要比生物类似药途径开展更多的临床试验,这样就增加了研发成本。至于需要增加多少成本,这取决于参照药,以及开发商是将可互换性测试整合进生物类似药试验,还是在药物作为生物类似药获得批准以后再单独开展可互换性测试。
今年1月,FDA发布一份指南,规定了一个连续的过程,在确定了生物类似性以后,通过逐步的方法用以明确生物类似药与原研生物药之间的可互换性。和生物类似性一样,FDA并没有提供一个单一的方法来证明可互换性。一个药物从生物相似性进展到可互换性,取决于多个因素,如生物药的复杂性,分析测试,所批准的每个适应症的作用机制,不同人群的免疫原性风险以及预期的毒性等。对于一些结构复杂的药物,这可能意味着,其需要先作为生物类似药上市,然后再开展上市后研究,用以证明这个候选药物与原研药具有可互换性。
对于那些在治疗过程中需要多次给药的生物药,开发商为了证明可互换性,必须与FDA批准的参照生物药进行更换药物的研究,以证明更换或者交替使用他们的药物与参照药,与仅使用参照药物相比,不会造成更大的安全风险或者导致疗效下降。虽然FDA表示计划让研究设计更加灵活,但是这个指南提出,用以评估可互换性的药物更换研究至少需要在候选药物和参照生物药之间更换2次。研究的主要终点应该评估临床PK,如果可能,还需要评估PD。
研究还将评估免疫原性和安全性。为欧盟和美国市场开发的生物类似药通常在研究中会包括一个药物更换试验,研究中,一组患者从参照药切换到生物类似药。虽然欧盟已经使用这类研究来建立对生物类似药替换原研药的信心,但是FDA的可互换性还是不能仅通过一次单向的药物更换来证明。因此,Mohan估计,遵循FDA的指南证明可互换性可能会导致生物类似药的开发成本增加12%。他指出,在药物更换研究中必须使用的,在美国获得批准的参照药物的价格,并不是一个无关紧要的因素。在美国,对于某些生物药,每位患者每年治疗的费用超过10万美元。而当生物类似药的开发商不得不购买一定数量的参照生物药用于分析测试、比较性研究和药物更换研究时,它们不可能从原研厂获得价格折扣。
为了控制开发成本,Oncobiologics与FDA和EMA合作,进行整合的试验设计,使得该公司修美乐的生物类似药在获批上市时获得可互换性的许可,在与其他开发修美乐生物类似药的公司竞争时处于优势。Oncobiologic的全球项目,同时符合了FDA和EMA的要求,将两套方案整合在一起,其中一个用于证明生物类似性,另一个证明可互换性,在同一组患者身上进行一年多的测试。
“在美国,可互换性改变了规则,”Mohan说。他指出,一个具可互换性的产品将具有市场优势。他期望,为证明可互换性而开展的多次药物更换试验将帮助大家建立起对生物类似药的信心。可互换性也使得生物类似药获得更大的患者基数。虽然,在美国和其他一些国家,生物类似药仅被用于新患者,但是,具有可互换性后,也可以用于现有的患者。
但是,可互换性本身就和试验设计一样,取决于治疗领域。例如,因为可用药时间相对较短,Mohan对癌症药物需要开展多次更换研究的可行性提出质疑。而与之对应,治疗糖尿病或者炎症疾病,患者需要终生服药。除美国以外,其他国家并没有单独设定可互换性的审评,生物类似药是否可以自动替代,情况各不相同。比如,欧盟并没有对药物替代做出规定,而让各个成员国自行决定。丹麦监管机构推荐医生让患者从类克更换至Celltrion开发的生物类似药。因此,这个生物药在丹麦上市后,头6个月就获得了90%的丹麦市场,Kim说道。在法国,生物类似药被鼓励用于新患者。
与此同时,对于证明患者从原研药更换至生物类似药的安全性,英国和挪威只要求单次更换的试验。为此,开展了一项名为Nor-switch的52周、盲法、随机试验,比较维持治疗的患者从Janssen的类克转而使用Celltrion的生物类似药Remsima的结果。该试验由挪威政府资助,评估了481名患有慢性炎症疾病的患者,这些患者之前已经接受了至少6个月的类克的治疗。最初的研究结果显示,原研生物药和生物类似药之间并没有差异。目前正在进行为期6个月的扩展研究,全部患者都将使用Remsima,这项研究即将结束。
虽然Nor-switch这项研究增强了对生物类似药的信心,但是并没有对在类克和Remsima之间多次更换的结果进行评估,也没有证明其他类克生物类似药的可互换性,而这两点对于慢性炎症疾病患者的未来用药很重要。该研究的批评者认为,由于Nor-switch研究中疾病恶化的数据来自于患有不同慢性炎症疾病的患者,这项试验并不能就特定的炎症疾病得出药物更换后效果的结论。
尽管受到设计上的限制,Nor-switch和其他一些研究还是为欧盟目前使用原研生物药的患者更换生物类似药铺平了道路。几年前,在英国,几家医院开展了数个案例研究,让使用类克的患者转而使用Celltrion的生物类似药。这一举措促使英国国家卫生与保健评价研究院(NICE)在新发布的指南里,呼吁系统地引入生物类似药,让Inflectra和Remsima来替代类克。
和欧盟类似,俄罗斯也不需要开展药物更换试验来确定可互换性。Romanov说,当前,所有获得批准的、使用相同的国际非专有药名(INN)的药品都被视为可互换。从去年开始,新获批的生物类似药必须开展一项可互换性的评估,但是不需要进行药物更换试验。之前获得批准的“仿制生物药”的生产商需要提交额外的数据,以证明药物与原研药之间的可互换性。从2018年起,当采购生物类似药时,俄罗斯政府需要企业提供可互换性的证明。
生产:灵活性和质量是关键
原研厂商和生物类似药的开发商都越来越多地关注生产,将其视为产品实现商业成功的战略驱动力。他们认为,生产可以在控制成本的同时提高产品质量,缩短上市时间并适应市场需求。对于未来的生物药生产厂,灵活性和质量将是关键。
生产一个生物药的成本是每克50~100美元之间。为了在未来激烈的竞争和定价压力下获得成功,生产商将不得不将成本降至5~10美元,同时维持或加强产品质量。而且,由于产品品种的扩大,需要更小的批量定额和更大的灵活性,这些都会损失规模经济。技术进步,如采用单次使用技术和连续化生产技术,则可以通过减少资源需求、降低设施规模要求和建设成本,提高产品质量以及实现多样化产品生产来补偿上述经济损失。
除了更具成本效益的生产技术,还必须开发新的基准、标准和最佳的操作流程,使生产更高效和灵活,以满足越来越多样化的和全球化的生物药/生物类似药管线的需求。所面临的挑战是,需要寻找方法来改进生产创新的实施流程,同时尽量减少监管风险,避免关键开发项目的延误。
需求增加的因素之一是很多新兴市场的基本药物是在国内进行生产。即使不需要国内生产,政府也可以通过激励本地产业来使竞争环境倾斜。Romanov说,例如,俄罗斯的政府采购就禁止从国外采购药物,而且还有更多的针对本国生产的激励措施。
从今年开始,俄罗斯的政府采购必须是使用本国生产的原料药进行生产的药品。同时,俄罗斯还为那些尚未在该国生产的原料药的开发提供资金。Romanov表示,由于这些激励措施,大多数大型制药公司已经在俄罗斯投建生产设施。展望未来,如果想要在俄罗斯销售他们的产品,海外的生物类似药公司也必须这样做。
虽然一些生物类似药的开发商正在一些必须或者优先考虑本国生产的关键市场兴建生产设施,另一些公司则采取了合作的方式。开发出全球首个正式的单抗生物类似药的Celltrion就采取了授权许可的模式,依赖于合作方的监管和生产经验,以在特定市场获得其生物类似药的批准。
作为创新生物药的先驱,安进公司已经建立了在全球具有竞争力的生产设施和合作伙伴关系。该公司拥有完整的单抗生物类似药产品管线,但是Foraker指出,上市时间将因产品和地区不同而异,基于参照生物药的专利到期时间、开发时间表、监管需求和其他因素。
如何进入该行业
为了在迅速发展的生物类似药市场取得成功,开发商(不论是自行开发还是通过合作伙伴关系进行开发)都需要具备以下几个能力:临床和监管专业知识、创新能力、合作能力、生产、法律和知识产权以及商业化能力。而且,正如一些早期的开发商所发现的那样,他们需要仔细考虑他们预期的市场,了解该地区的生物类似药监管环境,以及他们所针对的参照生物药。有些公司,他们的生物类似候选药物已经在新兴市场获得批准,却在欧洲被监管机构拒绝,这时候才意识到不同市场之间的差距就太晚了。另外一些公司意识到,在一个拥挤的市场或者大多数产品需要通过政府招标采购才能进入的市场,存在与其他产品竞争的困难性。生物类似药开发成本相对较高,在一个还未有生物类似药的市场,招标失败者只能被迫离开。
寻找参照生物药时需要考虑很多因素,专利到期时间、监管要求、竞争情况、开发成本、患者需求和医保这些因素在不同市场可能差别非常大。受专利到期和需求驱动,非格司亭和重组人促红细胞生成素成为了欧洲最早上市的生物类似药。EMA于2007年批准了5个重组人促红细胞生成素的生物类似药,2008–2014年则批准了7个安进公司Neupogen的生物类似药。今天,在欧盟地区,新的生物类似药的开发兴趣已经转移至单抗和胰岛素产品。
表3 欧盟批准的生物类似药(截至2017年8月1日)
| 生物类似药 | 通用名 | 研制机构 | 参照生物药 | 参照药开发商 | 批准日期 |
|---|---|---|---|---|---|
| Abasaglar | 甘精胰岛素 | 礼来 | 来得时(Lantus) | 赛诺菲 | 2014 年9 月 |
| Abseamed | epotein alfa | Medice Arzneimittel Pütter | Eprex/Erypo | 强生 | 2007 年8 月 |
| Accofil | 非格司亭 | Accord Healthcare | Neupogen | 安进 | 2014 年9 月 |
| Amgevita | 阿达木单抗 | 安进 | 修美乐(Humira) | 艾伯维 | 2017 年3 月 |
| Bemfola | follitropin alfa | Gedeon Richter | Gonal-F | 德国默克 | 2014 年3 月 |
| Benepali | 依那西普 | Samsung Bioepis | 恩利(Enbrel ) | 辉瑞 | 2016 年1 月 |
| Binocrit | epotein alfa | 山德士(诺华) | Eprex/Erypo | 强生 | 2007 年8 月 |
| Epoetin Alfa Hexal | epotein alfa | Hexal (诺华) | Eprex/Erypo | 强生 | 2007 年8 月 |
| Filgrastim Hexal | 非格司亭 | Hexal (诺华) | Neupogen | 安进 | 2009 年2 月 |
| Flixabi | 英夫利昔单抗 | Samsung Bioepis | 类克(Remicade ) | 强生 | 2016 年5 月 |
| Grastofil | 非格司亭 | Apotex | Neupogen | 安进 | 2013 年10 月 |
| Inflectra | 英夫利昔单抗 | 赫升瑞(辉瑞)(从Celltrion 获 得授权许可) | 类克(Remicade ) | 强生 | 2013 年9 月 |
| Inhixa | 依诺肝素钠 | 天道欧洲公司(深圳市天道医药有限公司) | 克赛(Clexane) | 赛诺菲 | 2016 年9 月 |
| Lusduna | 甘精胰岛素 | 默沙东(与Samsung Bioepis 合作开发) | 来得时(Lantus) | 赛诺菲 | 2017 年1 月 |
| 生物类似药 | 通用名 | 研制机构 | 参照生物药 | 参照药开发商 | 批准日期 |
| Movymia | 特立帕肽 | Stada Arzneimittel | 复泰奥(Forsteo) | 礼来 | 2017 年1 月 |
| Nivestim | 非格司亭 | 赫升瑞(辉瑞) | Neupogen | 安进 | 2010 年6 月 |
| Omnitrope | 生长激素 | 山德士(诺华) | 健豪(Genotropin) | 辉瑞 | 2006 年4 月 |
| Ovaleap | follitropin alfa | 梯瓦 | Gonal-F | 德国默克 | 2013 年9 月 |
| Ratiograstim | 非格司亭 | Ratiopharm(梯瓦) | Neupogen | 安进 | 2008 年9 月 |
| Remsima | 英夫利昔单抗 | Celltrion | 类克(Remicade ) | 强生 | 2013 年9 月 |
| Retacrit | epoetin zeta | 赫升瑞(辉瑞) | Eprex/Erypo | 强生 | 2007 年12 月 |
| Rixathon | 利妥昔单抗 | 山德士(诺华) | 美罗华(Mabthera) | 罗氏 | 2017 年6 月 |
| Silapo | epoetin zeta | Stada Arzneimittel | Eprex/Erypo | 强生 | 2007 年12 月 |
| Solymbic | 阿达木单抗 | 安进 | 修美乐(Humira) | 艾伯维 | 2017 年3 月 |
| Terrosa | 特立帕肽 | Gedeon Richter | 复泰奥(Forsteo) | 礼来 | 2017 年1 月 |
| Tevagrastim | 非格司亭 | 梯瓦 | Neupogen | 安进 | 2008 年9 月 |
| Thorinane | 依诺肝素钠 | Pharmathen | 克赛(Clexane) | 赛诺菲 | 2016 年9 月 |
| Truxima | 利妥昔单抗 | Celltrion | 美罗华(Mabthera) | 罗氏 | 2017 年2 月 |
| Zarxio | 非格司亭 | 山德士(诺华) | Neupogen | 安进 | 2009 年2 月 |
表4 欧盟推荐批准的生物类似药(截至2017年5月31日)
| 生物类似药 | 通用名 | 研制机构 | 参照生物药 | 参照药开发商 |
|---|---|---|---|---|
| Blitzima | 利妥昔单抗 | Celltrion | 美罗华(Mabthera) | 罗氏 |
| Erelzi | 依那西普 | 山德士 | 恩利(Enbrel ) | 辉瑞 |
| Insulin lispro Sanofi | 赖脯胰岛素 | 赛诺菲 | 优泌乐(Humalog) | 礼来 |
| Ritemvia | 利妥昔单抗 | Celltrion | 美罗华(Mabthera) | 罗氏 |
| Riximyo | 利妥昔单抗 | 山德士 | 美罗华(Mabthera) | 罗氏 |
| Tuxella | 利妥昔单抗 | Celltrion | 美罗华(Mabthera) | 罗氏 |
表5 EMA正在审评的生物类似药(截至2017年5月31日)
| 生物类似药 | 通用名 | 研制机构 | 申请数量 |
|---|---|---|---|
| 修美乐(Humira) | 阿达木单抗 | 艾伯维 | 2 |
| 安维汀(Avastin) | 贝伐珠单抗 | 罗氏 | 2 |
| 恩利(Enbrel ) | 依那西普 | 辉瑞 | 1 |
| 来得时(Lantus) | 甘精胰岛素 | 赛诺菲 | 1 |
| 优泌乐(Humalog) | 赖脯胰岛素 | 礼来 | 1 |
| Neulasta | pegfilgrastim | 安进 | 2 |
| 美罗华(Mabthera) | 利妥昔单抗 | 罗氏 | 2 |
| 赫赛汀(Herceptin ) | 曲妥珠单抗 | 罗氏 | 3 |
来源:EMA
尽管在欧洲,重组人红细胞生成素和非格司亭的生物类似药早已上市,但是这些药物的开发商们在试图进入美国市场时遇到了更大的困难。FDA已经批准了一个非格司亭的生物类似药——山德士的Zarxio,这个药于2015年在美国上市,成为美国第一个上市的生物类似药。同一年,2015年2月,FDA接受了加拿大公司Apotex的生物类似药Grastofil的上市申请。但很显然,这个药被拒绝了,因为10个月的审评期早已过去,而Apotex尚未披露FDA对这个药做出的审批决定,然而在2013年,EMA以非格司亭生物类似药的名义批准了Grastofil。
赫升瑞(Hospira)的Retacrit有着相类似的经历,这个重组人红细胞生成素的生物类似药在2007年获得欧盟的批准。2015年FDA接受Grastofil申请的同时,也接受了赫升瑞的这个生物类似药的上市申请。几个月以后,赫升瑞被辉瑞收购,FDA向赫升瑞发出完整答复信(CRL),要求其提供更多的数据。2016年12月,辉瑞再次提交申请,今年5月,FDA的专家委员会以14:1的投票结果支持批准这个生物类似药。但是FDA仍旧没有批准该药,而是向辉瑞发出了第二封CRL,其中指出了在预定的生产设施中发现的一些问题。
除了Zarxio,截至今年8月1日,FDA批准的生物类似药都是以重磅炸弹级的单抗为参照药,该机构披露的生物类似药在研产品也绝大多数瞄准了畅销的单抗药。由于法律的原因,在其他国家被批准为生物类似药的胰岛素和一些激素类产品,在美国,至少目前还不能遵循生物类似药途径进行申请。由于这类蛋白的参照药多年前是以小分子药物的审批途径在美国获得批准的,所以它们的生物类似药必须按照505(b)(2)途径申请。不过,2010年的法律授权,最初以新药申请(NDA)为途径获得批准的蛋白制品,其生物类似药将在2020年之前转而根据生物药途径审批。同时,新开发的蛋白类药物可以通过FDA的生物制品授权申请(BLA)途径审批。
FDA去年发布了一个指南草案,草案指出,到2020年3月23日,将以NDA获批的简单蛋白,如胰岛素和人生长激素“视为”BLA途径获批。该草案允许在这个日期之后,新的以这些蛋白为参照的仿制品以生物类似药途径获得批准,但是并没有解决那些已经以505(b)(2)途径批准的药物的问题。礼来的Basaglar(甘精胰岛素)2014年在欧盟获批,是欧盟批准的首个胰岛素的生物类似药,正在设法在美国获得批准。
礼来公司糖尿病市场顾问Dani Barnhizer说,“是依据美国《公共保健服务法》按照351(k)条款将这些药物‘视为’生物类似药,还是按照351(a)条款‘视为’原研生物药,FDA尚未确定。”这个决定将对Basaglar及其未来潜在的竞争对手造成一些监管上的影响。
尽管505(b)(2)和生物类似药两个审批途径名字有所不同,但是礼来发现,它们的审批路线大致相同。Barnhizer 指出,“根据FDA的生物类似药指南,当审评或者批准505(b)(2)产品,如Basaglar的时候,FDA使用了很多应用于生物类似药的科学原则。这与我们的经验是一致的,因为我们没有发现505(b)(2)注册路径与欧盟的生物类似药注册过程有任何实质上的区别。”
图3
表6 主要的生物类似药开发目标
| 美国 | 俄罗斯 |
|---|---|
| 阿达木单抗 | 利妥昔单抗 |
| 依那西普 | 曲妥珠单抗 |
| 英夫利昔单抗 | 凝血因子VIII |
| 利妥昔单抗 | 甘精胰岛素 |
| 贝伐单抗 | eculizumab |
| 曲妥珠单抗 | 干扰素β-1A |
| Pegfilgrastim | 英夫利昔单抗 |
| 人重组红细胞生成素 | 贝伐单抗 |
| 非格司亭 | Eptacog Alfa |
| 人低精蛋白锌胰岛素 |
来源:Cortellis,Biocad
由于这些法律上的特殊性以及患者使用上的原因,在美国畅销的药物未必是其他地区生物类似药开发的热点目标。比如,俄罗斯的10大生物类似药开发目标中,2个是胰岛素产品。而和美国相同,生物药在俄罗斯的药品支出中占有相当大的比重,占政府招标的前20大药品的一半。虽然修美乐在美国是最大的生物类似药开发目标,但在俄罗斯,它未能进入前10名。
图4
市场接受度
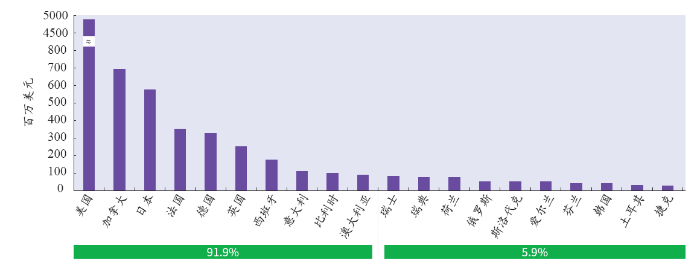
尽管美国的生物类似药市场刚刚开始形成,但其市场规模很大,成为单抗生物类似药成功的关键所在。Celltrion的Kim指出,仅美国一个市场,就占了全球英夫利昔单抗全部市场份额的59%。其次是加拿大,8.4%,日本以7.1%排名第3。英夫利昔单抗92%的销售是在10个国家完成的——美国、加拿大、日本、法国、德国、英国、西班牙、意大利、比利时和澳大利亚。
生物类似药进入市场后,并不能确保能够取代广泛使用的生物药,并节省下医疗支出,尤其是在那些由医生、患者或者私人付费方来决定使用何种产品的市场。欧洲的经验表明,态度的转变需要好几年的时间,但最终会转变。Kim说,2013年EMA批准了Celltrion的Remsima,那一年参与调查的欧洲克罗恩病和结肠炎组织(ECCO)会员中,只有28%的人表示相信生物类似药与参照生物药具有可互换性,或者可以替代患者目前使用的原研药物。3年后,该组织将近72%的会员承认生物类似药与原研药具有可互换性,或者可以替换原研药。
英国胃肠病学会(BSG)也发生了类似的态度转变。2014年,该学会称,除非有更多的安全性数据,否则,已经使用原研生物药的患者不应该转而使用生物类似药,反之亦然。Kim说,该学会还强调,在考虑生物类似药的任何明显的成本优势时,必须与这类药物“不确定的有效性和未知的风险”相权衡。到2016年,该学会表示,已经有足够的证据说明,可以让正在使用英夫利昔单抗的、病情稳定的患者从原研药转而使用生物类似药。
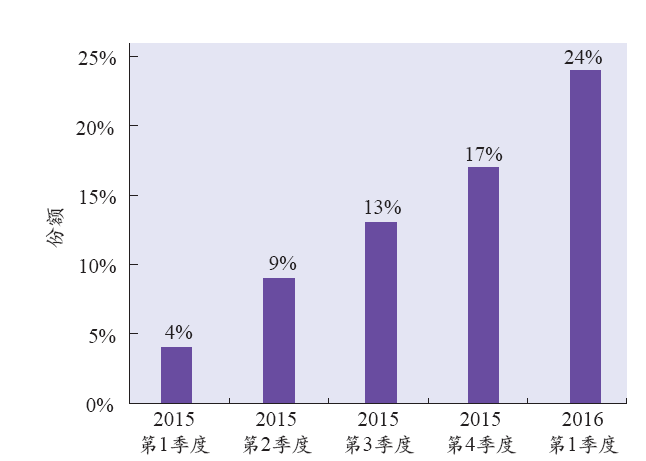
在欧盟,Celltrion的英夫利昔单抗生物类似药市场份额的不断增长也反映了这种态度的改变。2015年第一季度,Celltrion及其各个合作伙伴销售的这个生物类似药仅占欧盟英夫利昔单抗市场的份额的4%。一年后,占据了该市场的将近四分之一。到2016年下半年,另一个英夫利昔单抗的生物类似药——Samsung Bioepis的Flixabi也获得了欧盟的批准。
但是,Kim指出,市场份额的增长并不是在欧盟范围内平均分布,在医生试图将患者使用的原研药替换成生物类似药时,一些患者团体仍然继续提出质疑,并且要求将替换行为披露。
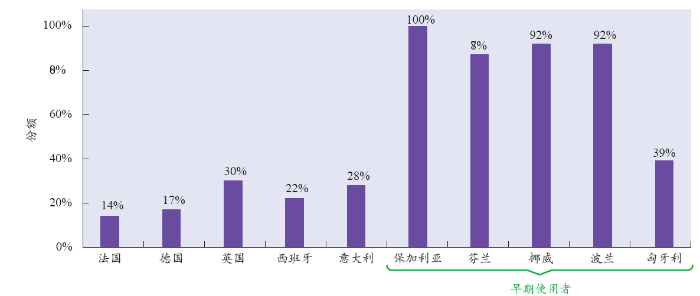
在欧洲,较早接受Celltrion的生物类似药的国家往往是那些通过政府招标采购药物的国家。在2016年第一季度,Celltrion的生物类似药仅分别占法国和德国英夫利昔单抗市场份额的14%和17%,却完全控制了整个比利时的市场,并且在挪威和波兰占有92%的市场份额。
2015年,Celltrion的两家合作销售方赫升瑞和Orion在挪威的政府招标中,给Remsima定出了相对原研药69%的折扣价,于是,挪威从那年开始使用这个生物类似药。几周后,芬兰公司Orion在挪威赢得招标,即使医生仍旧处方原研药类克,患者也能获得生物类似药,这使得一半以上接受英夫利昔单抗治疗的挪威患者转而使用Remsima。Norswitch试验的结果也说服了更多的医生和患者去使用价钱更便宜的生物类似药。
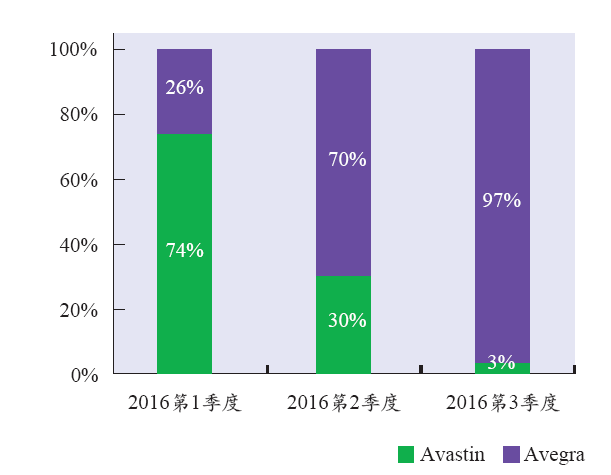
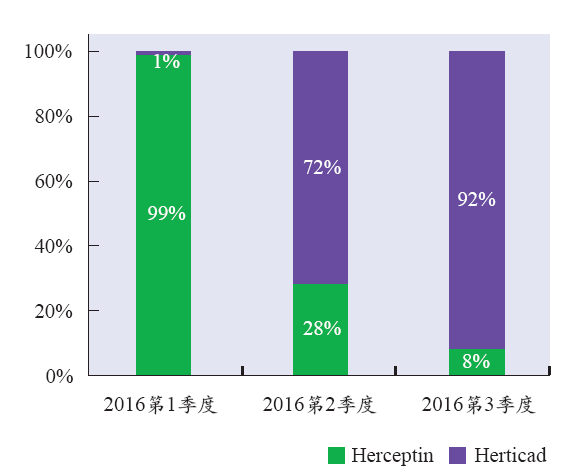
同样,Biocad的两个生物类似药在俄罗斯上市后也迅速取得了成功。在招标过程中,Biocad的生物类似药Avegra仅面对一个竞争对手,就是原研药罗氏的安维汀(贝伐单抗)。Avegra上市后,市场份额迅速从2016年第一季度的24%增长至第三季度的97%。该公司的另一个生物类似药Herticad,参照药为罗氏的赫赛汀(曲妥珠单抗),在俄罗斯的市场份额也有着类似的增长,从2016年第一季度的1%增加到第三季度的92%。Romanov将这两个生物类似药的成功归功于俄罗斯的政府招标,该国认定生物类似药与参照生物药具有可互换性,以及Biocad的产品具有相当可观的折扣价格。
图5
图6
图7
Romanov说道,与欧盟相同,因为价格下降,所以俄罗斯市场接受了生物类似药,而这也导致了这类药物使用面的扩大。
美国对生物类似药的态度远远落后于欧盟和俄罗斯。目前市场上只有两个生物类似药,一些医疗专业人员和患者仍然对生物类似药感到惶恐,怀疑仅测试了一个或两个适应症的生物类似药是否可以外推到所有原研药获批的适应症。去年,由“生物类似药论坛”(Biosimilars Forum)进行的一项对1 201名美国专科医生的调查显示,只有12%的被调查者完全接受适应症外推。
需要协调统一
外推原则、临床试验开发、命名方法和其他监管问题的全球协调统一将大大降低生物类似药的开发成本,并实现其他机遇。
适应症外推
适应症外推是简化生物制剂审批途径的关键概念,也是开发生物类似药的成本低于原研生物药的主要原因。如果开发商需要提供参照药每个获批适应症的临床数据,那么开发生物类似药比从头开始研发一个新的生物药还要麻烦。
去年,在为Celltrion的英夫利昔单抗生物类似药召开的一个专家委员会会议上,FDA生物技术产品办公室主任Steven Kozlowski表示,开发生物类似药时,开发商被要求“提交并确认”数据,而不是推翻它。外推的概念是,一旦一个生物类似药被确定为与参照药高度相似,就不必要一而再地证明其在所有适应症中的安全性和有效性。
但是,由于每个地区的监管机构会根据它的要求和特性来指定政策,所以外推并不适用于所有地区。在欧盟,EMA基于类风湿关节炎和银屑病的临床数据批准了英夫利昔单抗的生物类似药,并外推到其他类克的适应症,包括炎症性肠病(IBD)如溃疡性结肠炎和克罗恩病。而当加拿大卫生部于2014年批准这个生物类似药时,该机构就因为生物类似药和类克之间糖基化的差异而拒绝外推至IBD适应症。
一些在FDA关节炎专家咨询委员会任职的医生最初表达了对外推到IBD适应症的担心,他们担心在没有特定适应症应用临床数据的情况下如何处方药物。(在美国,英夫利昔单抗生物类似药测试了类风湿和强直性脊柱炎适应症而获批。)2016年4月,当FDA批准英夫利昔单抗生物类似药的时候,该机构同意药物外推到除儿科溃疡性结肠炎以外所有类克的适应症。儿科溃疡性结肠炎适应症的例外是因为类克拥有儿科的排他权益,直至2018年9月。
Biocad的Romanov表示,俄罗斯采用了EMA的方法,允许外推。如果药物在适应症中的作用机制是相同的,针对最敏感适应症获得的临床试验数据,可以外推至参照生物药的其他适应症。但是,俄罗斯监管机构要求,在不同治疗领域需要对适应症进行单独的III期研究。比如,利妥昔单抗(罗氏的美罗华)的生物类似药需要分别测试血液学和风湿病的适应症,然后才能获批原研药的所有适应症。
参照生物药
另外一个能从协调统一中受益的领域是生物类似药研究所使用的参照生物药。目前,FDA允许根据欧洲批准的参照生物药版本来进行测试,但是,即使欧盟和美国版本的参照生物药都是在同一家工厂使用相同工艺生产,开发商还必须进行桥接研究,以证明欧盟版本的参照产品与美国版本基本相同。FDA在可互换性上的要求更高,必须使用美国批准的参照药进行药物更换试验。这些要求增加了为多个市场开发生物类似药所需要的成本和时间,也导致了可及性问题,因为一些参照药的生产商已经使用了风险评估和缓解策略(REMS)或者自己设置的限制供应政策,以确保未来的竞争者无法获得开展实验所需要的参照生物药样本。
命名
生物类似药的命名是迫切需要协调统一的另一个问题。2014年,WHO出台了一项自愿的全球INN项目,呼吁每一个生物药,无论是原创药还是生物类似药,名称里都包括4个字母的生物学限定词(BQ),从而将共享核心INN名称、并具有同样活性组分的全部产品区分出来。每个BQ都同时具有前瞻性和追溯性,可以随机分配用于指定在特定工厂生产的生物活性物质。
不过,很多国家并没有遵循WHO的建议,而是基于自己的处方要求开发了自己的命名系统。由于WHO所提议时,生物类似药市场已经得到了很好的发展,欧盟会继续使用没有限定词的通用核心名称。2007年欧盟批准了两个重组人红细胞生成素,Retacrit和Stada Arzneimittel的Silapo,这是仅有的例外。虽然这两个生物类似药的参照药的INN都是epoetin alfa,但生物类似药的INN是epoetin zeta。这成为了处方和政府招标epoetin alfa时的障碍。
俄罗斯使用了与EMA和WHO指南都一致的生物类似药审批途径。Romanov说,在命名上,俄罗斯遵循欧盟的方案。
美国计划遵循WHO的提议,使用INN加上4个字母组成的无意义后缀,应用于原研生物药和生物类似药。但是截至目前,只有生物类似药被分配了后缀。
1月份,FDA完成了命名指南,将产业界和政策制定者区分开来。这些推动与仿制药相一致的举措设定了唯一的后缀,令人感到困惑,容易产生分歧,从而阻碍市场接纳价格更低的生物类似药。不过,原研药和生物类似药的开发商以及很多医生和患者团体都表示,BQ有助于开展药物警戒。虽然一些行业人士认为无意义后缀会带来一些问题,但是另一些人认为,这种命名结构可以确保开发商之间都是公平的,因此能促进竞争。
安进公司则赞成使用一个有意义的、可以区分的后缀。该公司的副总裁兼生物类似药总经理Scott Foraker表示,“作为一家同时开发原研生物药和生物类似药的公司,安进非常欢迎FDA的指南和法规为生物类似药(通过4个字母的后缀)设定一个可区分的非专利的名称。可区分的非专利命名是建立在透明和问责基础上的创建生物类似药审批制度的重要一步。生物类似药的独特后缀将使得每个产品都可以追溯到其开发商……并有意识地减少可能的不适当地或无意中更换生物药情况的发生。”
关于在美国建立生物类似药市场,Foraker说,“必须毫不妥协地确保患者的安全。为每个生物类似药分配一个可区分的非专利名称将有助于建立患者和医生的信心,确保生产商问责制,有助于确保供应的可靠性,并创建一个成功的市场。当然我们相信,如果这个可区分的非专利后缀便于记忆的话(而非FDA设定的那些无意义的名称),那这些目标则能够顺利的达成。”
直到批准第一个生物类似药后,FDA才提出命名方案。因此,Zarxio的后缀——filgrastim-sndz,是参考了药物生产商的名称来命名的。该机构批准的其他生物类似药的名称都包括一个无意义的后缀。尽管FDA发布的最终指南呼吁使用后缀,以追溯至参照生物药和之后新批准的生物药,但是目前还没有这样执行。FDA尚未确定可互换的药品的命名方案。同时,像安进这样的公司也继续对这个指南提出意见,敦促FDA重新考虑是否采用无意义的限定词。
影响竞争的因素
当生物类似药第一次成为可能时,很多决策者和仿制药公司预计,这个市场会像仿制药市场那样,随着越来越多的竞争对手的进入,价格迅速下跌,参照药最终退出。也有人坚持认为,生物类似药市场将更类似于品牌药市场,因为开发生物类似药需要更多的成本和时间,而且在一些国家,需要积极地进行推广,并将其与竞争对手区分出来。不管市场最终选择何种路线,很多制药公司还是愿意尽早在生物类似药上进行投资。对于一些公司来说,这是进入生物药市场的一个入口。而另一些公司,如安进,本身就是生物药公司的先驱者,在他们的重磅炸弹生物药受到挑战时,他们愿意去拥抱生物类似药,扩大产品线。而仿制药公司则将生物类似药作为他们拓展产品线的一个方法。
自EMA批准全球第一个正式的生物类似药至今已有11年,对于一些公司,如Biocad,生物类似药的吸引力已经在减弱。虽然这家俄罗斯公司致力于开发和上市生物类似药,但是Romanov表示,该公司将不会再启动新的生物类似药项目。与此相反,公司将聚焦于开发创新药。他指出了做出这一决定的一些因素,包括价格竞争、监管要求的持续变化、与后续产品的竞争以及生物类似药和原研生物药之间的内部收益率差距正在缩小。
价格竞争
Romanov说,在仿制药市场,一旦有一些仿制药上市,原研药通常只能退出,而生物类似药与此不同,与参照生物药之间的价格竞争非常激烈,有一些原研药在生物类似药上市后给出了大幅的折扣。在美国,生物类似药的折扣平均为15%,在欧盟是20%~30%,而原研药不但拥有生物类似药所没有的强大的市场认可,而且也能够给出与之类似甚至更大的折扣。令人担忧的是,如果这样,原研厂商就可以驱动市场竞争,阻止更多的生物类似药的开发,从而长期维持垄断和价格控制。
鉴于美国生物类似药开发和批准的落后,参照生物药的生产商可以提高在美国的药价,以弥补其在欧盟和其他市场因生物类似药大量上市而被迫提供竞争性药价所带来的损失。因此,随着生物类似药在其他地方成为现实,很多生物药在美国经历了巨大的价格上涨。与此同时,原研开发商在生物类似药竞争到来之前,在其他国家率先降低了参照生物药的价格,使得生物类似药的开发商只能以更低的价格上市,阻碍了生物类似药的进一步开发。由于原研药生产商已经从重磅炸弹级生物药中获取了多年的利润,因此他们能够负担降价,但是生物类药开发商因为试图收回研发投资,需要承担产品上市和营销的所有成本,所面临的财务状况可能更加危险。
生物类似药市场的一个方面可能与仿制药市场类似,那就是,随着同一原研药的更多生物类似药的上市,价格有望进一步下降。为了保持竞争力,同时降低成本,一些生物类似药开发商正依靠新的生产技术来帮助降低产品价格。但是,原研厂商也能够从同样的技术中获益,公司经济规模是决定最大赢家的决定因素。
除了降低生产成本,市场本身也将在激烈的生物类似药竞争中发挥作用。在招标主导的市场,价格最低的投标人才能获得签单,从长远的角度来看这会阻碍竞争,因为一家公司不可能只对一个特定的市场持续增加某个生物类似药的生产,否则在下一轮招标中前面的赢家就会失去合同。因为这个天然的特性,这类完全被招标控制的市场将阻碍多个生物类似药的出现。
即使中标者也很难达到生物类似药的成本预期。赫升瑞和Orion的英夫利昔单抗生物类似药在挪威招标竞争时,尽管其他一些开发商被生物类似药快速占领市场所鼓舞,但是他们认为,因为开发和生产药物的成本,这样的折扣无法长期持续。
Romanov说,在很多新兴市场,“在生物药的招标采购中,价格是唯一的成功因素。”除了可能将价格压低至一个可持续的水平以外,这种专注于价格的做法会在这些国家造成一个不平衡的环境,继续允许不符合现在生物类似药标准的“仿制品”存在下去。Romanov补充,“与这类仿制生物药竞争的唯一途径就是降低价格的同时催生更加严格的监管要求。”未来,这些仿制生物药因为不能达到标准,可能将被迫离开市场,但是已经被它们压低的价格可能会使真正的生物类似药的竞争受到阻碍。
在任何一个市场,存在的问题都是多个生物类似药能否长期存在。艾美仕的报告指出,2016年,欧盟市场上首发上市的生物类似药具有优势,第一个上市的生物类似药通常拥有最大的市场份额。平均来说,2016年欧洲第一个上市的TNF抑制剂生物类似药产品拥有这类市场70%的份额。促红细胞生成素(EPO)市场,这个数字是73%。
虽然报告显示,只有生物类似药的威胁才有助于控制价格,但是阻碍竞争是否会导致未来开发的生物类似药更少,对于这一点还存在疑问。根据报告,欧盟的经验表明,哪怕没有多个生物类似药进行竞争,一个生物类似药也能够降低医疗费用,但是竞争将有助于长期维持折扣价格。
为了确保生物类似药的竞争,一些监管机构正在采取方法防止原研厂商出台阻止竞争的定价方案。今年5月,英国竞争和市场管理局(CMA)发现默沙东出台的类克的折扣方案破坏了竞争法规,有可能会限制英夫利昔单抗生物药的竞争(在欧洲,Janssen将类克的权益授权给默沙东)。CMA正在继续调查这个药品的折扣问题。
在美国,FDA在批准创新药和生物类似药时,不涉及定价,但是政府的报销政策可能会影响到定价和生物类似药的竞争情况。2016年医疗保险医师收费表(Medicare Physician Fee Schedule,MPFS)涵盖了医疗提供方所使用的药物,医疗保险和医疗补助服务中心(CMS)通过了一项有争议的政策,给予所有针对同一个特定参照药的生物类似药同一个支付代码,同时给予原研药一个唯一的代码,因此很多开发商担心这会严重阻碍生物类似药的使用。Medicare基于平均销售价格为生物类似药支付费用,而市场上所有的生物类似药都是用同一个代码,与此同时,原研的医保支付费用是价格的6%,这样的定价结果政策使得生物类似药互相残杀,而原研药得到了保护。美国一些国会议员呼吁CMS改变当前的Medicare Part B政策,
FDA数据
66个生物类似药开发项目正在进行中*
9家公司公开宣布
已经提交了14个生物类似药的申请*
涉及25参照药
81个会议申请,2016财年
73个会议计划,2016财年
来源:FDA
*截至2017年6月1日
并为每个生物类似药分配一个单独的代码,以符合BPCIA的要求。
CMS正在重新考虑其报销方案,但这并不是Medicare将生物类似药置于不利地位的唯一政策。去年,Avalere Health的一项分析显示,Part D下的处方药覆盖存在问题,使用生物类似药的患者可能要比使用参照药的自付更多的费用。Avalere进行了一个假设分析,假设有一个年费用为3万美元的参照药和价格折扣25%的生物类似药,根据2017年Part B计划,使用生物类似药的患者需要支付39%的费用,即1 536美元,比使用参照生物药的要多。
品牌差异化
美国的生物类似药市场正在形成品牌竞争,这一点也许比其他地区更甚。每个生物类似药开发商都需要区分其品牌,并与药房福利管理公司(PBM)进行谈判,以纳入私人保险公司和政府医保计划的药品处方集。这样的市场更加有利于具有一定生产历史和营销能力,并且拥有更广泛的产品线,能够与PBM进行谈判的生物药公司。而且,这看上去并不会阻碍开发商对生物类似药的兴趣。
Foraker介绍,安进公司既是原研生物药的开发商,也是生物类似药的开发商,它计划利用其通过原研药在核心治疗领域所建立的商业能力来营销生物类似药。这些能力包括销售、市场、定价、医保报销、患者服务和外包。安进还依靠该公司丰富的产品线和品牌资产,开发出国际商业战略,用于特定生物类似药以及正面临生物类似药竞争的原研生物药。
今年早些时候,安进与医疗服务公司Harvard Pilgrim Health Care签署了一份创新性的协议,协议基于类风湿关节炎药物恩利(依那西普)的疗效来决定支付费用。协议为期两年,有一个6项标准组成的算法,包括患者依从性、是否需要更换或增加药物、剂量递增以及类固醇干预等。如果患者评分低于指定的水平,Harvard Pilgrim就会因为实际疗效的减弱而减少该药物的支付费用。
这份协议签署前几个月,FDA批准了恩利的生物类似药,山德士的Erelzi。去年这个药物获得批准之后,诺华旗下的山德士表示,计划尽快在美国上市Erelzi。不过因为安进对恩利这个原研药的专利保护,Erelzi的上市还需要一段时间。恩利在美国的大多数专利要到10~20年后才会过期,因此需要等专利诉讼过后Erelzi才有可能上市。
去年,美国市场的几个主要PBM宣布, 2017年,在处方中集中用生物类似药替代参照生物药。这一趋势将迫使原研药开发商采取与安进相类似的策略,与PBM和医疗保健计划方进行谈判,用创新的定价方案进行竞争。
在美国,品牌差异化的另一个方面是,原研生物药厂商通常提供患者资助方案(PAP)。大多数原研公司提供储值卡、优惠券或其他方案资助参保患者的自付费用,所以一些患者几乎没有花什么钱在昂贵的参照生物药上。由于政府资助的医保计划,如Medicare和Medicaid禁止使用PAP的福利,原研药公司就与基金会或其他组织合作,来资助没有参保的患者,并且让符合资格的Medicare或Medicaid受益人可以免费获得它们的药品。
因为生物药和生物类似药的价格,在美国PAP将成为主要的竞争因素,生物类似药的PAP必须达到或者超过原研药。但是对患者的支持不仅仅是对自付费用的资助。很多患者希望,制药公司能够提供医学上的支持,有专家能够回答他们的问题,并且能即时提供指导。当山德士上市Zarxio时,该公司所提供的援助方案与安进为Neupogen提供的相类似。如果生物类似药因为竞争加剧提供更大的折扣,这类方案是否仍然存在,这一点还有待观察。另外,在患者不知道或者不能控制他们所使用的生物类似药的种类,或者不了解其可互换性的情况下,竞争激烈的市场会如何运作,也需要进一步的观察。
Foraker表示,“在患者援助项目上,安进有着悠久的历史,有一系列的项目可以满足患者的独特需求,帮助补偿药物的费用。”他还说,“目前,为我们的生物类似药产品推荐患者援助计划还为时尚早。”
阻碍竞争的因素
虽然生物类似药的开发商可以在定价或招标过程中展开竞争,但是在处方集谈判,甚至是PAP方面,原研药公司所拥有的一些优势可以延迟生物类似药的上市,或者抬高竞争的价格。
药品的获得
几个月前,Momenta制药高级副总裁兼法律总顾问,生物类似药委员会主席Bruce Leicher告诉美国众议院医疗监管委员会,竞争的最大障碍是原研药厂滥用REMS和限制分销系统,而这一点在美国尤甚。
Leicher说,越来越多的原研药公司“躲在公共安全的掩护下”,拒绝让可能的竞争对手获得生物等效性研究和生物类似药试验所需要的药物。即使在原研药失去专利保护后,这些公司仍旧试图保护其价格昂贵的专科药和重磅炸弹级药物。近年来,这个情况越来越多。当Momenta接触批发商购买某些药物的时候,经常会被询问是否使用这些药物用来开发仿制药或者生物类似药。如果答案是肯定的,批发商会说,根据它与原研药厂的合同,它将不能提供药物给你。
Leicher表示,获取样品是Momenta决定开发哪个生物类似药的重要因素,无法获得参照药品时,唯一的办法就是诉诸法庭,或者换一个生物类似药。他说,“为了以一个合理的市场价购买样品,需要打 3年官司,然后才开始着手开发,这个代价我们负担不起。”
Monmenta不是唯一一个面临这个问题的公司。FDA的Janet Woodcok证实,该机构收到的来自仿制药和生物类似药开发公司的投诉已经超过150个,称原研厂商因REMS而拒绝向它们提供样品。在这种情况下,FDA将审查开发方案,并且告知原研药公司,预期的用途不会违反REMS。但是除了将案件提交给美国联邦贸易委员会(FTC)以外,FDA并不能强迫原研药公司将药品出售给潜在的竞争对手。美国国会已经提出了一些法案来解决这个问题。
由于FDA要求研究必须使用美国获批的药物来证明可互换性,所以药物的获得可能会成为在美国获得可互换性的大问题。Oncobiologics的Mohan表示,美国药价昂贵,原研药企可以拒绝提供药物,可互换性的开发商需要花费更多的成本和更长的时间用以开发。他还补充说,原研药企可以利用这个监管的要求,在美国这个利润最高的市场推迟可互换性药品的竞争。
专利
另一个障碍是围绕创新生物药的一系列专利。虽然小分子药物也受到一些专利的保护,但在一些国家,生物药可能拥有超过50个专利,专利保护期可以延长多年。生物类似药的开发商可以围绕某些特定的专利设计并挑战其他一些专利。但是专利挑战需要时间和金钱,这增加了生物类似药进入市场的成本。在美国,FDA接受的每一个生物类似药申请都已经卷入诉讼,而已经上市的少数几种生物类似医药也面临着风险。
下一代产品
除了专利挑战,下一代,或者下一阶段的重磅炸弹级生物药的版本也有效延长了原研药的独占期。Biocad的Romanov说,“原研药企继续开发下一代产品是常见的且非常有效的对抗生物类似药威胁的方法。”即使在知识产权保护有限的新兴市场,原研药企也可以积极向监管机构和医疗界推出药物的“新的改进型”版本,哪怕这个新药只能提供一些边际效益,如更方便的用药方式或者剂量,也可以打击以老版本作为参照药开发的生物类似药的使用。
Romanov说,“必须基于卫生技术或者药物经济学,对替代第一代产品的下一代产品是否有真正的重大改进进行评估,在没有这类透明决策系统的市场,下一代产品的价格只要不超过第一代原研药就可以了。”通过这种方法,市场就不知不觉地阻碍了竞争,让垄断长期存在。这种方法也阻碍了能够带来真正创新研发的投资。
总结
生物类似药的发展可能会促进竞争并节约医疗费用,但机会也许并不如原先预测的那样多。竞争的情况在很大程度上取决于监管途径、医保报销制度和市场接受度。全球统一,监管政策和报销方案对于创造可持续的竞争环境至关重要。要想提高市场接受度,生物类似药开发公司必须做好功课,对医生进行教育,并确保患者的安全和产品质量。