过去10年,作为仿制药中心,中国的制药市场在药物的研发方面有了巨大增长,目前已成为全球第三大制药市场,并预计于2017年超过日本。中国的人口老龄化、研发资金增长、监管力度加强、从事医疗保健行业的专业人员和研究机构数量迅速增加等现状引起了国际社会的广泛关注,因此,中国制药市场对于那些希望降低制药成本而同时不降低药物质量的投资人越来越有吸引力。
基于多种数据源,其中主要是科睿唯安 Cortellis临床试验情报数据库,通过回顾中国的临床试验和早期研发信息,揭示中国制药行业的概貌。与其他国家的制药行业比较后发现,中国制药行业正在发生快速变化。本文呈现了中国制药行业在过去10年中所发生的改变,并力图揭示中国制药行业的未来走向。
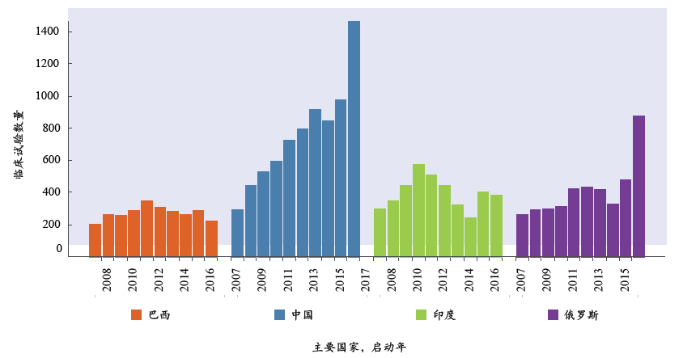
中国的临床试验启动数量近10年稳步增加。图1展示了金砖4国每年启动临床试验的数量。
图1
中国的临床试验起动数量在过去10年稳步上升,2016年比2007年高出4倍多,与其他一些金砖国家(如,巴西与印度)2012年到2016年临床试验数量减少的情况形成鲜明对照。2007年中国起动的临床试验数量占金砖4国试验总量的25%,2016年已升至50%。
有趣的不只是临床试验起动的数量,其试验阶段的数量也在不停变化。2007–2016这10年,中国从临床试验的最后阶段即临床4期和跨国3期向更具创新性的1期和2期试验转变。这一转变比金砖4国的其他国家更引人注目(如图2)。
图2
这种向更具创新性的早期临床试验阶段的转变,表明中国制药产业在早期临床试验阶段发挥着更大的作用。事实上,对Web of Science(WoS))近期的出版物进行的一项调查显示,2005年到2016年期间,在WoS上出版的中文论文增长了近300%,而在Scopus这个更大的数据库中增长了近180%。2015年WoS出版的文章中1/5来自中国,而10年前中国只占1/10。这些论文中不乏取得了显著成果的研究,包括第一个获批的启动于2014年的基因治疗试验以及目前正在进行的第一次人类CRISPR试验。
创新来自哪里?在中国,学术界更倾向于从事临床试验。事实上,与同行业群体相比,中国学术界发起并承担的临床试验数量超过了50%,这一比例远远高于印度、巴西、俄罗斯等金砖国家(图3)。
图3
虽然学术界参与比例显得很高,但值得注意的是该分析囊括了中国境内所有由研究人员领导的研究,学术界在临床试验占比大约为40%(研究单位或医院发起的研究性临床试验)。即使如此,中国不断增加的研发投入正在产生回报,过去10年的年研发增长率大约为20%。此外,中国新发布的创新政策鼓励本土医药企业的创新。中国正在完善自己的医药研发机制,中国本土医药企业研发的新药和医疗器械越来越多。
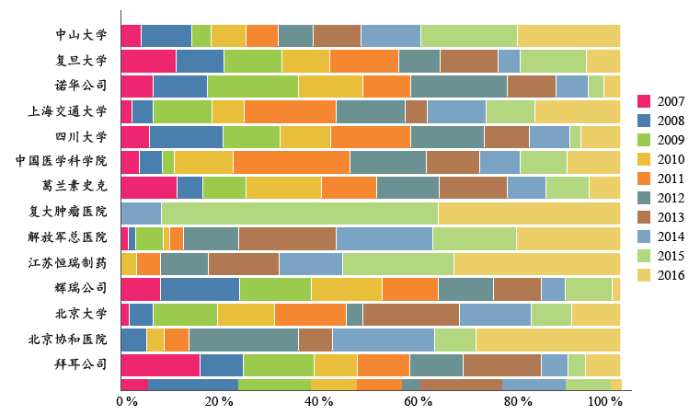
2007–2016年,中国学术机构开展的临床试验数量超过了其企业同行。排名前10的临床试验组中有7组是学术团体(如图4)。从图中可以看出,这些学术团体早期阶段的临床试验数量不大(图中蓝色部分)。
图4
在国际大制药企业中,只有诺华和葛兰素史克(GSK)两家公司跻身开展临床试验数量前10的机构名单中,并且这两家公司在过去几年都减少了临床试验的数量。恒瑞作为中国企业的佼佼者,在开展临床试验的数量上也有骄人的表现。而且可以看出恒瑞开展的临床试验以早期为主,这也符合中国临床试验整体进展的大趋势。如此看来未来中国医药行业的创新发展仍需学术机构(及下属医院)的支撑。这一结果可以从各机构每年启动的临床试验数量的比例中得出(图5),学术机构(及下属医院)的右侧色块比较大,显示学术机构(及下属医院)的临床试验数量近年在增加,而跨国公司启动的临床试验数量在减少。
图5
图6
最后,通过分析金砖4国主要开展的研究发现,这几个国家都在大量投资非胰岛素依赖性糖尿病(NIDD)的研究,而中国正大力推进多类型癌症的临床试验研究,并且是金砖4国中唯一对肝癌的研究位居世界前5的国家。
伴随着2013年国家食品药品监管总局(CFDA)的建立,以及近期国务院一系列药政改革意见的颁布,有关加速创新药临床方面的法规细则必将逐渐完善。预计中国制药产业未来的增长趋势将取决于近期的监管程序的完善的速度。中国国家食品药品监管总局曾经针对国外企业研发的创新药有过规定,境外制药商只能在中国申请除疫苗外的药物临床试验,且至少在境外已进入II期临床试验。但现在这些要求已不存在,并且允许境外制药商使用国际多中心临床试验数据在中国进行新药审批,而全球同步申报和上市已经成为可能。随着这一系列改革政策的进一步细化落地,我们预计中国的临床试验数量将会不断增长,并接近全球领先水平。