基于对SSU rRNA的系统发育分析,Woese于1977年提出了著名的三域学说,将那些生活于极端环境(如高盐、高温、低pH和缺氧等)中的古菌(Archaea)作为一个生命域独立出来,与细菌域(Bacteria)和真核生物域(Eucaryota)并列为生物的三大域。随后,进一步将可培养的古菌分为广古菌门(Euryarchaeota)和泉古菌门(Crenarchaeota)。广古菌门包括分布广泛且生理特征多样的产甲烷菌、极端嗜盐菌、嗜热嗜酸菌和嗜热菌;泉古菌门代表位于系统发育树根部最原始的古菌类群,主要为嗜热菌,如热球菌属(Thermococcus)和热网菌属(Pyrodictium)。其后又在1994年和2002年分别建立了初古菌门(Korarchaeota)和纳米古菌门(Nanoarchaeota)。但由于这两个门目前均只发现一个种,且数量不多,所以广古菌门和泉古菌门仍然是古菌的两大主要类群,并被冠以生存于“极端环境”的特征。
1992年,Delong和Fuhrman等利用PCR扩增、克隆和测序的方法对海水中古菌的16S rRNA基因进行了分析,首次发现海洋中存在大量未被培养和认识的古菌。这些古菌因在系统发育树上与泉古菌门接近,且来自中温环境,因而被命名为中温泉古菌(non-thermophilic Crenarchaeota)。后续研究发现中温泉古菌在土壤、沉积物、淡水系统等环境中也广泛分布,数量可达海洋浮游生物总数的20%,在土壤中约占原核生物的1%~5%。但对这类数量巨大、分布广泛的古菌的生理代谢及生态功能的研究一直进展缓慢。直到2004年,宏基因组学研究发现海洋古菌基因组中含有类似细菌编码氨单加氧酶的结构基因amoA、amoB和amoC。2005年从西雅图水族馆海水中分离培养到第一株氨氧化古菌(Ammonia-oxidizing archaea, AOA),证实了古菌也能催化氨氧化过程。氨氧化古菌的发现从根本上改变了上百年来人们对氨氧化过程由细菌主导驱动的传统认识,同时也揭开了人们对这类中温古菌生理、遗传代谢和生态功能认识的序幕。
随后大量的分子生态学研究表明, 氨氧化古菌广泛分布于包括海洋、湖泊和土壤等在内的多种环境中,其数量通常远远高于氨氧化细菌(Ammonia-oxidizing bacteria, AOB),预示其在硝化过程中可能起着重要作用。我们课题组于2005年左右开展了氨氧化古菌的分子生态学研究,利用定量聚合酶链反应(qPCR)、变性梯度凝胶电泳(DGGE)和克隆测序等方法,对不同土壤包括酸性红壤、碱性潮土、高氮牧草地土壤和低氮高原冻土中AOA和AOB的多样性特征及其与土壤环境因子的相互关系进行了一系列研究,发现AOA在我国南方酸性红壤中(pH 3.7~6.0)大量存在且丰度大于AOB,其组成对长期施肥所导致的土壤性质(尤其是酸度)的变化比AOB更敏感,二者的丰度均与土壤的硝化潜势呈显著正相关;但在中性和碱性土壤中则相反,AOA的数量和组成对不同施肥处理、氮投入水平、土地利用方式或海拔梯度变化等没有明显响应,而AOB的变化则很明显。在大区域尺度上,土壤pH是影响氨氧化古菌和细菌分布的主要驱动因子。这些研究结果揭示了氨氧化古菌对不同环境条件变化的响应差异以及影响其分布的主要驱动因子,暗示了酸性土壤中氨氧化古菌对土壤硝化作用的贡献可能更重要,研究成果在Environmental Microbiology, FEMS Microbiology Ecology, Nature Geoscience等杂志上发表后在学术界产生重要影响,被SCI期刊文章广泛引用。
以上研究以及当时国内外的大量研究报道在不同环境中都检测到高丰度的AOA,但AOA对土壤硝化作用的贡献没有直接证据,成为国际上争论的焦点问题。因此我们与英国阿伯丁大学合作,利用稳定性同位素探测技术(SIP)就AOA的功能活性开展研究。SIP技术通过以稳定性同位素基质原位培养样品,以使微生物的核酸等被标记,再通过DNA/RNA分析来鉴定参与了同位素底物利用的功能微生物,这是当时研究土壤微生物功能最有力的工具。由于氮(N)在核酸中的相对含量较低以及14N和15N不易分离等原因,以15N基质对参与氮转化的微生物进行标记较困难,限制了该技术在硝化微生物研究中的应用。我们利用氨氧化微生物氧化氨的同时固定CO2为碳源进行化能自养生长的特性,以13C-CO2替代15N-铵源为底物来标记氨氧化微生物,解决了这一难题。在实验室微宇宙培养条件下,分别利用13CO2和12CO2对一低氮高有机质土壤进行标记培养,发现13C-CO2被结合到AOA的amoA基因和参与古菌CO2固定途径——3-羟基丙酸/4-羟基丁酸循环的关键功能基因hcd基因中,但未被标记到AOB的amoA基因中,表明AOA能够利用CO2为碳源进行自养生长,同时催化氨的氧化,在土壤的硝化作用中起着决定作用。这些结果于2010年10月在《美国国家科学院院刊》发表后(Zhang, et al., PNAS, 107:17240-17245),引起国内外同行的广泛重视和引用。该研究被认为“首次为氨氧化古菌参与土壤硝化作用提供了直接证据,对于理解土壤氮循环过程具有重要意义”。在以上对AOA和AOB的分子生态学研究中,我们推测AOA在酸性土壤中更活跃,对酸性土壤的硝化作用可能至关重要。因此我们利用13CO2-SIP技术也对酸性土壤进行了标记培养研究,类似地发现酸性土壤中是AOA而不是AOB主导着硝化作用,该结果2012年发表于《国际微生物生态学会会刊》上(Zhang, et al., ISME J, 6: 1032-1045),为理解酸性土壤的硝化作用机理提供了重要依据。同时期,国际同行对氨氧化古菌纯培养的研究也取得许多突破,从海洋和土壤环境中成功分离培养了数株氨氧化古菌,获得更多有关其生理代谢和遗传学特征的信息。如对第一株氨氧化古菌纯培养物海洋亚硝化短小杆菌(Nitrosopumilusmaritimus)的研究发现,该菌对氨的亲和力和利用效率明显高于AOB,很好地解释了AOA适应极端寡营养环境条件的机理(Martens-Habbena, et al., Nature, 2009, 461: 976-U234)。2011年还从英国苏格兰酸性土壤中成功富积培养到第一株嗜酸性氨氧化古菌——阿伯丁土壤亚硝化细杆菌(Nitrosotaleadevanaterra),其适宜的生长pH为4.0~5.0,当pH>5.5时生长受抑制,更进一步证实了AOA在酸性土壤硝化过程中的重要作用(Lehtovirta-Morley, et al., PNAS, 2011, 108: 15892-15897)。这两个研究从生理学的角度很好地解释了我们通过13CO2-SIP技术研究发现的AOA在低氮和强酸性土壤的硝化过程中起主导作用的原因:NH3是自养氨氧化过程的直接底物,酸性土壤中高浓度的H+离子使大部分NH3以NH4+离子态存在,实际代表了低NH3的环境,AOA因其对氨的高亲和力和适应低pH条件使其优胜于AOB在这些不利的环境条件下起主导作用。此外,我们的结果与同时期国际上其他研究小组报道的碱性和高氮土壤硝化作用主要由AOB驱动的研究结论互为补充,共同阐释了AOA和AOB的生态位分化特征。这些结果相互印证,深入地推进了对氨氧化古菌生理代谢和遗传机制的认识和理解。
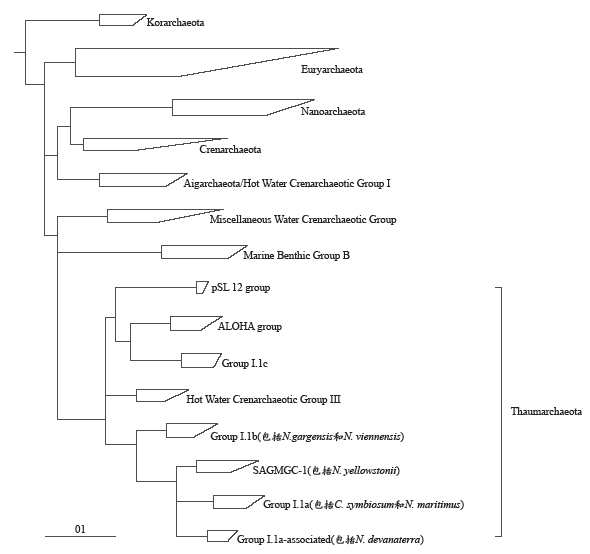
与此同时,越来越多的研究显示氨氧化古菌所代表的这类中温古菌在系统发育、遗传组成等方面与泉古菌门和广古菌门明显不同,因此,Brochier-Armanet等在2008年(Nat. Rev. Microbiol, 6: 245-252)建议将包括氨氧化古菌Group I.1a和I.1b、来自酸性土壤的Group I.1c、来自开放海域的ALOHA Group、来自热泉和热液口的pSL12 Group和HWCGIII/Nitrosocaldus Group等所代表的这类中温泉古菌划分为一个新的门(如图1),成为古菌域的第三个主要类群,命名为Thaumarchaeota,希腊语“Thaumas”指“wonder(奇妙的)”,我们将之翻译为“奇古菌门”(张丽梅,贺纪正. 微生物学报,2012, 52: 411-421),这一新古菌门提出后迅速得到其他研究证据的支持和认可。近来的研究结果为我们展示了奇古菌的更多另人惊奇的特征:如在氨氧化和固碳方面,AOA还表现出更多与AOB不同的生理生化和遗传特征,虽与AOB氧化氨的机理相同,即经氨单加氧酶(AMO)将氨氧化为羟胺(NH2OH),再进一步氧化为亚硝酸根,但在古菌的基因组中一直未能找到与细菌类似的羟胺氧化酶(HAO)同源体及其编码基因(hao),其可能通过完全不同的酶复合体进行羟胺的氧化(Vajrala,et al., PNAS, 2013, 110: 1006-1011)。此外,不同于氨氧化细菌通过卡尔文循环固定碳,AOA通过更节省能量的3-羟基丙酸/4-羟基丁酸途径固定CO2进行自养生长(Walker,et al., PNAS, 2010, 107: 8818-8823;Konneke,et al., PNAS, 2014, 111: 8239-8244)。除自养代谢外,AOA还含有有机碳代谢途径,可进行混合营养型生长,能够直接利用有机碳源。从酸性海水中还培养获得两个专性混合营养生长的AOA菌株,能同时营化能自养固碳并耦合同化吸收海水中的有机物质,再次揭示了奇古菌多样的生理代谢方式及其在海洋生态系统食物网中的重要作用(Qin,et al., PNAS, 2014, 111: 12504-12509)。最近还发现AOA也是N2O排放的主要贡献者,除已证实其在硝化作用过程中产生释放N2O外,在氨氧化古菌模式菌株N. maritimus SCM1中还发现了编码亚硝酸盐还原酶的nirK基因,其在低氧条件下表现出较高的反硝化作用潜力(Walker, et al., PNAS, 2010, 107: 8818-8823; Loscher, et al., Biogeosciences, 2010, 9: 2419-2429)。在海洋、土壤和淡水沉积物等环境中也检测到丰度的奇古菌的nirK基因,暗示奇古菌也广泛参与了反硝化作用,进一步说明了其在整个氮循环中起着非常重要的作用。
除参与碳氮循环外,还发现N. maritimus中存在甲基膦酸的生物合成途径,可生成细胞相关的甲基膦酸酯。因为表层海水的氧浓度与大气氧浓度相当,本不利于甲烷产生,但在很多区域存在表层海水甲烷饱和的现象,被称为“海洋甲烷悖论”,最近发现这部分甲烷其实由海洋中受磷饥饿的微生物分解利用甲基膦酸而产生,但海洋甲基膦酸的来源并不清楚。奇古菌甲基膦酸生物合成途径的发现为揭开“海洋甲烷悖论”提供了合理的解释(Metcalf,et al., Science, 2012, 337: 1104-1107)。最近的研究还发现另一株氨氧化古菌加尔加亚硝化球菌(Nitrososphaera gargensis)可通过氰酸酶的作用代谢利用氰酸盐(cyanate),将其转化为铵以供给自身进行氨氧化作用(Palatinszky, et al., Nature, 2015, 524: 105-U227)。氰酸盐为氰氢酸的氧化产物或者尿素水解的产物,性质不稳定,在自然环境中不会大量长期存在,但在低浓度条件下可在海水中长期存在,其可能通过氨氧化古菌的代谢作用促进了海洋氮循环过程。氨氧化古菌对氰酸盐代谢能力的发现再次挑战了人们对微生物驱动的氮循环的认识,也再次向我们展示了奇古菌高度多样和另人惊叹的生理代谢特性和功能。
奇古菌具有高度的多样性,并在各种环境中广泛分布,但目前对其生理代谢、遗传特征和生态功能的认识仅仅是冰山之一角。迄今为止仅得到约10株氨氧化古菌富积培养物,除进一步加强对奇古菌的分离培养研究外,借助新一代高通量测序、宏转录组学和单细胞分析技术,并结合各种原位分析手段(SIP和二次离子质谱技术)和其他地球化学研究方法,探索奇古菌在生态系统元素和物质转化中的功能作用及其中的遗传机理是今后研究的重点。
The authors have declared that no competing interests exist.