DNA甲基化是表观遗传修饰的一种重要方式。哺乳动物中DNA甲基化主要发生在CpG双核苷酸中胞嘧啶的五位碳原子上,可以引起染色质结构和基因活性的改变,在基因印迹、X染色体失活、发育调控以及转座子沉默和基因组稳定性的维持等方面发挥重要作用。
有人把基因组甲基化比作细胞的记忆,当分化成生殖细胞和精卵结合产生下一代时就要抹去“前世”的记忆,涅槃重生。这么比喻是由于在哺乳动物中,基因组甲基化水平随着个体发育和繁殖呈现周期性的变化,其中两次大规模的去甲基化分别发生在卵子受精到着床前胚胎的早期发育过程中和原始生殖细胞发育的配子发生过程中。不仅如此,在体细胞分化过程中也存在着特定基因位点的小规模去甲基化。那么DNA去甲基化是如何发生的呢?其中的机制是什么呢?这一直以来是表观遗传领域的重大科学问题。
学术界长期认为5mC是稳定的表观遗传修饰,去甲基化是通过DNA复制而发生的被动稀释来实现的。然而由于被动去甲基化的不特异性、不完全性以及DNA甲基化与去甲基化对细胞命运决定的重要性,对于在上述两个大规模去甲基化过程中可能存在酶介导的主动去甲基化过程,研究人员始终没有放弃探寻。可是两次大规模去甲基化过程发生在精卵结合后以及原始生殖细胞发生过程中,细胞来源有限并且发生时间较短,因此无法获得足够数量的细胞进行分子生物学实验以鉴定基因,更无法用生化方法纯化酶。面对这个科学难题,许多科学家提出假设,许多实验室在几十年间也做过大量的尝试。1999年,加拿大Moshe Szyf实验室在Nature上发文声称发现了去甲基化酶,它有甲基化CpG识别结构域,并且可以把5mC催化成C,这在当时轰动一时,然而国际上其他实验室无法重复这个实验结果。另一个轰动的发现是在2008年,美国David Jones实验室与Bradley Cairms实验室合作发现脱氨酶AID(activation induced cytidine deaminase)可以把5mC脱氨生成T从而产生G/T错配,后者在含甲基化CpG结合区域的糖苷酶(MBD4)以及TDG糖苷酶介导的碱基切除修复途径(BER)下替换成C。然而之后在AID敲除的小鼠中没有发现发育致死现象,并且全基因组甲基化水平与不敲除相比变化不大,提示这个途径可能不是最关键的主动去甲基化途径。直到2009年,美国科学院院士Anjana Rao实验室发现DNA双加氧酶Tet1可以在体外将5-甲基胞嘧啶氧化成5-羟甲基胞嘧啶(5hmC)。同年另一实验室发现5hmC广泛存在于大脑浦肯野细胞中,为之提供佐证,这使得人们对DNA去甲基化机理的认识有了新的思路。
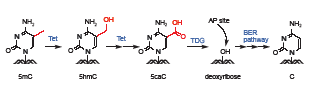
在此基础上,2011年,上海生命科学研究院生化细胞所的徐国良课题组首次提出氧化作用与碱基切除修复途径协同介导的DNA主动去甲基化机制[He YF, et al., Tet-mediated formation of 5-carboxylcytosine and its excision by TDG in mammalian DNA. Science, 2011, 333(6047): 1303-1307]。实验室最早受粗糙脉胞菌中尿嘧啶代谢补偿途径的启发展开了研究。在这种真菌中,胸腺嘧啶在胸腺嘧啶水解酶的作用下被逐步氧化为5-羧基尿嘧啶,后者在异乳清酸脱氢酶(IDCase)作用下转变为尿嘧啶U。研究人员首先优化了Tet蛋白的体外反应条件,在辅因子二价铁离子和a-酮戊二酸以及1 mmol/L的ATP的存在下,将含5mC或者5hmC的DNA模板作为反应底物与Tet蛋白反应一段时间后,通过高效液相色谱(HPLC)和薄层层析(TLC)分离检测的方法显示5mC或5hmC被转化成了一种新的修饰碱基形式。经质谱鉴定,确定这种新的修饰为5caC。在正常哺乳动物细胞中,5caC含量极低,常规方法检测不到。在HEK293T细胞中过表达Tet2蛋白后可在基因组DNA中检测到5caC,而过表达Tet2突变体蛋白则不可以,说明Tet蛋白通过氧化作用将5mC转变成了5caC。那么5caC又是怎么转变成未经修饰的胞嘧啶C呢?哺乳动物细胞中是否存在类似IDCase的脱羧酶直接去掉5caC的羧基呢?事实上,目前还没有证据表明哺乳动物细胞中存在可以直接在DNA双链上进行脱羧反应的酶。2010年,英国剑桥大学Azim Surani实验室的研究显示BER途径参与小鼠生殖系的重编程过程,这与发生大规模去甲基化的时间窗口吻合。然而BER途径最上游的糖苷酶均是切割G/U错配,是否能够切割G/5caC仍然不得而知。He YF等纯化了目前已知的BER途径上游参与切割G/U错配的四种糖苷酶,即TDG、MBD4、UNG2及SMUG1。糖苷酶活性分析结果显示只有TDG能够在体外特异性地切除5caC。细胞实验进一步表明,在外源Tet过表达的293T细胞中本应该能检测到的5caC在过表达TDG后消失。用TDG抗体免疫敲除内源TDG的胚胎干细胞(ESC)的核抽提物对5caC的切除活性也明显降低。Tdg knockdown或者Tdg knockout的ES细胞核抽提物切除5caC的能力也降低,并且细胞基因组中呈现5caC的积累。以上结果说明5mC和5hmC均可以被Tet双加氧酶进一步氧化产生一种新的碱基形式5caC,并且5caC可以被TDG糖苷酶特异性识别并切除,进而启动BER修复途径将原来的5mC替换成未修饰的C,从而实现真正的DNA去甲基化过程(图1)。
同期的Science杂志上,美国北卡罗来纳大学、霍华德休斯医学研究所华人科学家张毅教授实验室也发现Tet蛋白可以在体外将5mC氧化成5fC和5caC,但他们没有继续研究5caC如何转变成未修饰的胞嘧啶。因此,徐国良实验室第一次基于体内和体外的实验手段从分子水平上相对完整地勾画出了一条DNA主动去甲基化的途径,诠释了TDG介导的5caC切除这一去甲基化过程重要的一环,极大地推动了对DNA主动去甲基化机制的认识。
随后,Tet-TDG介导的DNA主动去甲基化在早期胚胎发育、成体神经发生、造血干细胞分化、配子发生以及体细胞重编程等过程中的作用被该实验室和国际同行深入研究。大规模的全基因组测序阐释了DNA主动去甲基化在这些细胞命运转变中呈现的规律现象。尽管如此,仍有很多未解之谜等待大家去解开。比如TDG在受精卵中不表达,且TDG缺失受精卵中的去甲基化过程并未受影响,是否暗示在Tet3介导的5mC氧化去甲基化的下游可能存在不依赖于TDG的其他去甲基化途径?另外5hmC、5fC以及5caC仅仅是代谢过程中的中间产物还是能和5mC一样独立地作为一种表观遗传标记起到生物学作用?近年来发现的DNA上新的修饰形式6-甲基腺嘌呤(6mA)是否具有生物学意义又是如何代谢调控的?DNA上是否存在除甲基化之外其他的修饰形式?DNA上氧化修饰碱基的生物学意义仍有待进一步研究。
The authors have declared that no competing interests exist.